Kuparikloridi (I) (CUCL) -rakenne, ominaisuudet, käytöt
- 4182
- 890
- Dr. Travis Reichert
Hän Kuparikloridi (i) Se on epäorgaaninen yhdiste, jonka on muodostanut kuparin (Cu) ja kloorin (Cl),. Sen kemiallinen kaava on cucl. Tämän yhdisteen kuparin valencia on +1 ja kloori -1. Se on valkoinen kiteinen kiinteä kiinteä, joka altistuessaan pitkään ilmassa saa vihertävän värin, koska kupari (i) hapettiin kupariin (II).
Se käyttäytyy Lewis -happona, joka tarvitsee elektroneja muita yhdisteitä, jotka ovat Lewis -emäksiä, joiden kanssa muodostavat kompleksisia tai stabiileja addukteja. Yksi näistä yhdisteistä on hiilimonoksidi (CO), joten kykyä liittyä niiden välillä käytetään teollisesti virvoitusjuomien CO: n purkamiseen.
 Kuparikloridi (I) (CUCL) puhdistettu. Leiem/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons.
Kuparikloridi (I) (CUCL) puhdistettu. Leiem/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons. Sillä on optisia ominaisuuksia, joita voidaan käyttää kevyissä puolijohteissa. Lisäksi CUCL -nanokubeilla on suuri potentiaali käyttää tehokkaissa energialaitteissa.
Sitä käytetään pyrotekniikan taiteessa, koska kosketuksessa liekin kanssa tuottaa sinertävän vihreän valon.
[TOC]
Rakenne
CUCL muodostuu cuproso -kuppi -ionilla+ ja anionikloridi Cl-. Ion Cu: n elektroninen konfiguraatio+ On:
1s2 2s2 2 p6 3s2 3P6 3D10 4S0 -
Ja se johtuu siitä, että kupari menetti 4S -kerroksen elektronin. Kloridi -ionissa on kokoonpano:
1s2 2s2 2 p6 3s2 3P6
Voidaan nähdä, että molemmilla ionilla on täydelliset elektroniset kerrokset.
Tämä yhdiste kiteytyy kuutiometrillä. Alla olevassa kuvassa havaitaan atomien järjestely kiteisessä yksikössä. Vaaleanpunaiset pallot vastaavat kuparia ja vihreitä palloja klooriin.
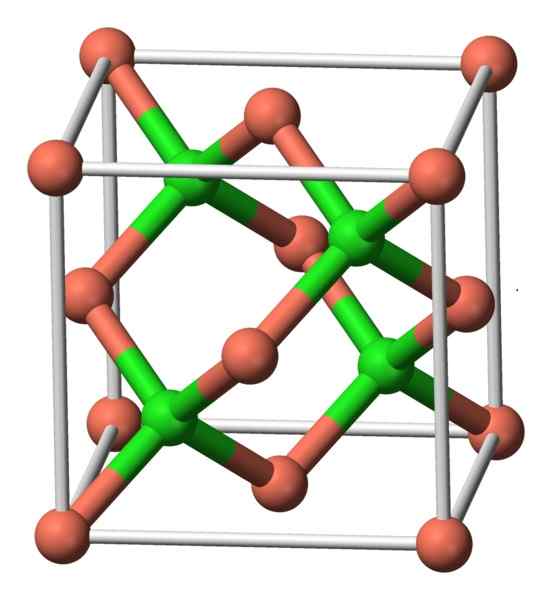 CUCL -rakenne. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons.
CUCL -rakenne. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons. Nimikkeistö
- Kuparikloridi (i)
- Kuplikloridi
- Kuparimonokloridi
Ominaisuudet
Fyysinen tila
Kiteinen valkoinen kiinteä aine, joka pitkittyneessä ilmassa ilmalla on hapettu ja muuttuu vihreäksi.
Molekyylipaino
98,99 g/mol
Sulamispiste
430 ºC
Kiehumispiste
Noin 1400 ºC.
Tiheys
4137 g/cm3
Liukoisuus
Lähes liukenematon veteen: 0,0047 g/100 g vettä 20 ° C: ssa. Liukenematon etanoliin (C2H5Voi) ja asetoni (valitse3(C = o) ch3-A.
Se voi palvella sinua: AliLo: Allyic Unit, Carbocation, Radical, EsimerkitKemialliset ominaisuudet
Se on epävakaa ilmassa, koska cu+ on taipumus hapettaa Cu2+. Ajan myötä kupric -oksidi (CuO), kuproksinen hydroksidi (CuOH) tai kompleksi oksikloridi ja suola muuttuu vihreäksi.
 Kuparikloridi (I), joka on altistunut ympäristölle ja hapettu osittain. Cuoh, cuoh ja muut yhdisteet voivat sisältää. Benjah-BMM27 / julkinen verkkotunnus. Lähde: Wikimedia Commons.
Kuparikloridi (I), joka on altistunut ympäristölle ja hapettu osittain. Cuoh, cuoh ja muut yhdisteet voivat sisältää. Benjah-BMM27 / julkinen verkkotunnus. Lähde: Wikimedia Commons. Vesipitoisessa liuoksessa se on myös epävakaa, koska hapettumis- ja pelkistysreaktio tapahtuu samanaikaisesti, muodostaen metallisen kuparin ja kuparinionin (II):
Cucl → cu0 - + Cucl2
Cucl lewis -happona
Tämä yhdiste toimii kemiallisesti Lewis -happona, mikä tarkoittaa, että se on innokas elektroneille, joten se muodostaa stabiilit adduktit yhdisteillä, jotka voivat tarjota ne.
Se on erittäin liukoinen suolahapossa (HCL), missä Cl -ionit- He käyttäytyvät elektronien luovuttajina ja CUCL: n kaltaisina lajeina2-, Cucl32- ja cu2Cl42-, muun muassa.
 Tämä on yksi lajeista, jotka muodostetaan HCL: n CUCL -liuoksissa. Kirjoittaja: Marilú Stea.
Tämä on yksi lajeista, jotka muodostetaan HCL: n CUCL -liuoksissa. Kirjoittaja: Marilú Stea. Vesipitoisilla CUCL -liuoksilla on kyky absorboida hiilimonoksidia (CO). Tämä imeytyminen voi tapahtua, kun nämä liuokset ovat sekä happamia että neutraaleja tai ammoniakin kanssa (NH3-A.
Tällaisissa ratkaisuissa on arvioitu, että muodostetaan erilaisia lajeja, kuten Cu (CO)+, Käki)3+, Käki)4+, Cucl (co) ja [cu (co) cl2--, joka riippuu väliaineesta.
Muut ominaisuudet
Sillä on sähköoptisia ominaisuuksia, alhainen optinen menetys laajalla valonspektrin alueella näkyvästä infrapuna-, matala taitekerroin ja vakio dielektrisyys matala.
Saada
Kuparikloridi (I) voidaan saada reagoimalla metalli kupari suoraan kloorikaasulla lämpötilassa 450-900 ° C. Tämä reaktio koskee teollisesti.
2 cu + cl2 → 2 cucl
Voit käyttää myös pelkistävää yhdistettä, kuten askorbiinihappoa tai rikkidioksidia kuparikloridin (II) siirtämiseksi kuparikloridiin (I). Esimerkiksi SO: n tapauksessa2, Tämä hapetetaan rikkihapoksi.
2 cucl2 + Sw2 + 2 h2O → 2 cucl + h2Sw4 + 2 HCL
Sovellukset
CO -korotusprosesseissa
Absorboivien ja Insorber -ratkaisujen kyky.
Voi palvella sinua: TurbidimetriaEsimerkiksi Cosorb -niminen prosessi käyttää stabiloitua kuparikloridia monimutkaisen suolan muodossa alumiinilla (Anycl4), joka liukenee aromaattiseen liuottimeen, kuten tolueeni.
Liuos absorboi kaasumaisen virran CO: n sen erottamiseksi muista kaasuista, kuten CO2, N2 ja ch4. Sitten monoksidirikas liuos lämmitetään alennetussa paineessa (ts. Atmosfäärinen) ja CO on Exorg. Tällä tavalla talteen otettu kaasu on korkea puhtaus.
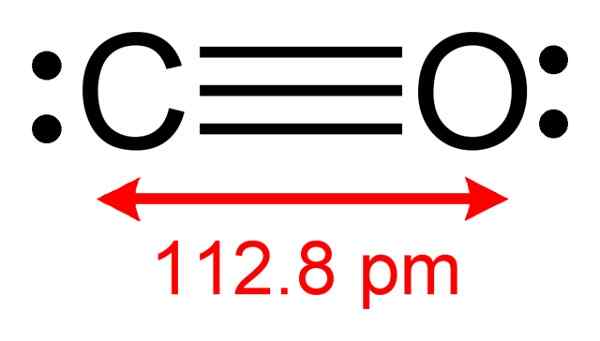 Hiilimonoksidirakenne, jossa havaitaan elektroneja kompleksin muodostamiseksi CUCL: n kanssa. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons.
Hiilimonoksidirakenne, jossa havaitaan elektroneja kompleksin muodostamiseksi CUCL: n kanssa. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons. Tämän prosessin avulla voit hankkia puhtaan CO: n.
Katalysoinnissa
CUCL: tä käytetään katalysaattorina erilaisille kemiallisille reaktioille.
Esimerkiksi germanio (GE) -elementin reaktio vetykloridilla (HCL) ja eteeni (CH2= Ch2) voidaan tehdä tällä yhdisteellä. Se palvelee myös orgaanisten piiyhdisteiden synteesiä ja rikin ja typen heterosyklisiä orgaanisia johdannaisia.
Voit syntetisoida polyfenileneteripolymeerin käyttämällä 4-amypiriiniä ja kyykkykatalyyttistä järjestelmää. Tämä polymeeri on erittäin hyödyllinen sen mekaanisten ominaisuuksien, pienen kosteuden imeytymisen, sähkön erinomaisen eristämisen ja palonkestävyyden suhteen.
Orgaanisten kupariyhdisteiden hankkimisessa
Alkenilcupratato -yhdisteet voidaan valmistaa reagoimalla terminaali Alky.
Saadaan polymeerit yhdistyneet metalleihin
Kuparikloridi (I) voidaan koordinoida polymeerien kanssa, jotka muodostavat monimutkaisia molekyylejä, jotka toimivat katalyytteinä ja jotka yhdistävät heterogeenisen katalyytin yksinkertaisuuden homogeenisen säännöllisyyden kanssa.
Puolijohteissa
Tätä yhdistettä käytetään saamassa materiaalia.
Näillä materiaaleilla on laaja käyttö ultraviolettivaloa säteilevissä diodeissa, laser diodeissa ja valonilmaisimissa.
Voi palvella sinua: kaliumbromidi (KBR): rakenne, ominaisuudet, käyttötarkoituksetSuper CardPisors
Tämä tuote, joka on saatu kuutio- tai nanokubien nanohiukkasten muodossa, mahdollistaa superkaaperien valmistuksen, koska sillä on erinomainen kuormitusnopeus, korkea palautuvuus ja pieni kapasitanssin menetys.
Superkarvat ovat laitteita energian tallentamiseksi, jotka erottuvat niiden suuritehoisesta tiheydestä, toiminnasta toiminnassa, nopea kuormitus- ja purkausjaksot, pitkän aikavälin vakaus ja ovat ympäristöystävällisiä.
 Nanocubos CUCL: ää voitaisiin käyttää elektroniikan ja energian varastointisovelluksissa. Kirjoittaja: Tide hän. Lähde: Pixabay.
Nanocubos CUCL: ää voitaisiin käyttää elektroniikan ja energian varastointisovelluksissa. Kirjoittaja: Tide hän. Lähde: Pixabay. Muut sovellukset
Antaa.
 Joidenkin ilotulitteiden vihreä väri voi johtua kuorsauksesta. Kirjoittaja: Hans Braxmeier. Lähde: Pixabay.
Joidenkin ilotulitteiden vihreä väri voi johtua kuorsauksesta. Kirjoittaja: Hans Braxmeier. Lähde: Pixabay. Viitteet
- Mileek, J.T. ja Neuberger, M. (1972). Kloridi. Julkaisussa: Lineaarinen sähköoptiset modulaariset materiaalit. Springer, Boston, MA. Linkki palautettu.Jousto.com.
- Lyijy, d.R -. (Toimittaja) (2003). CRC: n kemian ja fysiikan käsikirja. 85th CRC -lehdistö.
- Sneeeden, r.P.-Lla. (1982). Imeytymis-/disorptiomenetelmät. Kattavassa organometallisessa kemiassa. Nide 8. ScienEdirect.com.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Chandrashekhar, V.C. et al. (2018). Viimeaikaiset edistykset organometalli- ja koordinaatioyhdisteiden suorassa synteesissä. Metallikompleksien suorassa synteesissä. ScienEdirect.com.
- Kyushin, S. (2016). Organosilikonisynteesi organosilikoniklusterien rakentamiseksi. Tehokkaissa menetelmissä piiyhdisteiden valmistamiseksi. ScienEdirect.com.
- Van Koten, G. ja Noltes, J.G. (1982). Organokoppariyhdisteet. Kattavassa organometallisessa kemiassa. Nide 2. ScienEdirect.com.
- Danieluk, D. et al. (2009). Piilakalvolla olevien cucl -kalvojen optiset ominaisuudet silittämättömien ja happea. J Mater Sci: Mater Electron (2009) 20: 76-80. Linkki palautettu.Jousto.com.
- Yin, b. et al. (2014). Kuparikloridi -nanokupit, jotka on kasvatettu kuparin epäonnistumisessa pseudokapitorilektrodeille. Nano-mikro-lett. 6, 340-346 (2014). Linkki palautettu.Jousto.com.
- Kim, k. et al. (2018). Erittäin tehokas aromaattinen amiiniligandi/kupari (I) klooridi. Polymeerit 2018, 10, 350. MDPI toipui.com.
- Wikipedia (2020). Kupari (i) kloridi. Haettu jstk.Wikipedia.org.
- « Molaarinen fraktio miten se lasketaan, esimerkkejä, harjoituksia
- Butiarisen rasvan hankkiminen, tyypit, koostumus, käytöt, edut »

