Erot orgaanisten ja epäorgaanisten yhdisteiden välillä

- 1075
- 2
- Alonzo Kirlin
Se Erot orgaanisten ja epäorgaanisten yhdisteiden välillä Ne eivät ole aina yksinkertaisia, eivätkä he noudata muuttumattomia sääntöjä, koska kemian kannalta on olemassa symmfiinejä, jotka ovat ristiriidassa tai kyseenalaistavat aiempaa tietoa. On kuitenkin ominaisuuksia, jotka sallivat havaita monien yhdisteiden keskuudessa, jotka eivät ole epäorgaanisia.
Määritelmän mukaan orgaaninen kemia on tutkimus, joka sisältää kaikki hiilikemian haarat; Siksi on loogista ajatella, että heidän luurankonsa koostuvat hiiliatomista. Toisaalta epäorgaaniset luurankot (ilman pääsyä polymeereihin) koostuu yleensä mistä tahansa muista jaksollisen taulukon elementista kuin hiili.
Elävät olennot, kaikilla asteikoillaan ja ilmaisuillaan, on käytännössä hiilellä ja muilla heteroátomosilla (H, O, N, P, S jne.-A. Joten kaikki maankuoren kattavat viheralueet sekä sen päällä kulkevat olennot ovat eläviä esimerkkejä sekoittuneista orgaanisista yhdisteistä, jotka ovat komplekseja ja dynaamisesti.
Toisaalta maapallon poraaminen ja vuorilla löydämme rikkaat mineraalirungot koostumuksesta ja geometrisistä muodoista, jotka ovat suurimmassa osassa epäorgaanisia yhdisteitä. Jälkimmäinen määrittelee myös melkein kokonaan hengittämämme ilmapiirin sekä valtameret, joet ja järvet.
Orgaaniset yhdisteet | Epäorgaaniset yhdisteet | |
Atomit, jotka säveltävät sen | Ne sisältävät hiiliatomeja. | Ne koostuvat muista elementeistä kuin hiilestä. |
Ne ovat osa .. | Ovat osa eläviä olentoja. | Ne ovat osa inerttejä olentoja. |
Lähteet, joissa he ovat | Ne ovat vähemmän runsaasti luonnollisissa lähteissä. | Ne ovat runsaampia luonnollisissa lähteissä. |
Yhdisteiden tyypit | Ne ovat yleensä molekyyliä. | Ne ovat yleensä ionisia. |
Linkkityypit | Kovalenttiset linkit. | Ionien linkit. |
Molaariset massat | Suuremmat molaariset massat. | Alempi molaarimassa. |
Monimuotoisuus | Ne ovat vähemmän monimuotoisia. | Ne ovat monimuotoisempia elementtejä. |
Fuusio- ja kiehumispisteet | Vähäiset fuusio- ja kiehumispisteet. | Korkeammat fuusio- ja kiehumispisteet. |
Tärkeimmät erot orgaanisten ja epäorgaanisten yhdisteiden välillä
Epäorgaaniset yhdisteet saadaan luonnollisista lähteistä runsaampia kuin epäorgaanisten yhdisteiden lähteet
 Sokerikiteitä (oikea) ja suola (vasen) nähty mikroskoopissa. Lähde: Oleg Panichev [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Sokerikiteitä (oikea) ja suola (vasen) nähty mikroskoopissa. Lähde: Oleg Panichev [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Vaikka voi olla poikkeuksia, epäorgaaniset yhdisteet saadaan yleensä luonnollisista lähteistä runsaampia kuin orgaanisten yhdisteiden lähteet. Tämä ensimmäinen ero johtaa epäsuoraan lausuntoon: epäorgaaniset yhdisteet ovat runsaampia (maan päällä ja kosmossa) kuin orgaaniset yhdisteet.
Tietysti öljypaikassa, hiilivedyt ja siihen liittyvät vallitsevat, ovat vallitsevia, jotka ovat orgaanisia yhdisteitä.
Palattuaan osioon, se voidaan mainita esimerkkinä sokerisaltissa. Sokerikiteet (vankemmat ja fasted) ja suolat on esitetty yllä (pienempi ja pyöristetty).
Sokeri saadaan sarjan prosessien jälkeen sokeriruokoistutuksista (aurinkoisilla tai trooppisilla alueilla) ja sokerijuurikkaista (kylmillä alueilla tai talvien alussa tai syksyllä). Molemmat ovat luonnollisia ja uusiutuvia raaka -aineita, joita kasvatetaan niiden oikeaan satoon asti.
Voi palvella sinua: ratkaisujen standardisointiSamaan aikaan suola tulee paljon runsaammasta lähteestä: meri tai järvet ja suolat, kuten Halita Mineral (NaCl). Jos kaikki sokeriruoko- ja sokerijuurikkaat koottaisiin, ne eivät koskaan pystyneet vastaamaan luonnollisia suolavarantoja.
Epäorgaaniset kiteet ovat yleensä ionisia, kun taas orgaaniset kiteet ovat yleensä molekyyliä
Kun otetaan esimerkki sokeri-ulkoisesta parista, tiedämme, että sokeri koostuu sakkaridista, nimeltään sakkaroosi, joka puolestaan hajoaa glukoosiyksiköksi ja toiseksi fruktoosiksi. Sokerikiteet ovat molekyyliä, koska ne määritellään sakkaroosilla ja niiden molekyylien välisellä vetysillalla.
Sillä välin suolakiteet muodostavat Na -ioniverkon+ ja cl-, jotka määrittelevät kasvoihin keskittyneen kuutiometrin rakenteen (FCC).
Keskeinen kohta on, että epäorgaaniset yhdisteet muodostavat yleensä ionisia kiteitä (tai ainakin korkean ionisen luonteen niillä). On kuitenkin useita poikkeuksia, kuten CO -kiteitä2, H2S, niin2 ja muut epäorgaaniset kaasut, jotka kiinteytyvät alhaisissa lämpötiloissa ja korkeissa paineissa, ja ovat myös molekyylisiä.
Vesi edustaa tärkeintä poikkeusta tähän pisteeseen: Jää on epäorgaaninen ja molekyylikite.
 Harva lumi tai jää ovat vesikiteitä, erinomaisia esimerkkejä epäorgaanisista molekyylikiteistä. Lähde: Sieverschar de Pixabay.
Harva lumi tai jää ovat vesikiteitä, erinomaisia esimerkkejä epäorgaanisista molekyylikiteistä. Lähde: Sieverschar de Pixabay. Mineraalit ovat pohjimmiltaan epäorgaanisia yhdisteitä, ja niiden kiteet ovat siksi pääosin ionisia luonteeltaan. Siksi tätä toista pistettä pidetään pätevänä epäorgaanisten yhdisteiden laajalle spektrille, mukaan lukien suolat, sulfidit, oksidit, tellurot jne.
Orgaanisissa yhdisteissä hallitseva linkkityyppi on kovalenttinen
Sama sokeri- ja suolakiteitä jättävät jotain kysymystä: entinen sisältää kovalenttisia (suunta) -yhteitä, kun taas jälkimmäisellä on ioniset (ei -suuntaiset) linkit (ei -suuntainen).
Tämä kohta korreloi suoraan toisen kanssa: molekyylikiteellä on välttämättä oltava useita kovalenttisia sidoksia (jakamalla pari elektronia kahden atomin välillä).
Orgaaniset suolat luovat jälleen tiettyihin poikkeuksiin, koska niillä on myös voimakkaasti ioninen luonne; Esimerkiksi natriumbentsoaatti (C6H5Pata) on orgaaninen suola, mutta bentsoaatin ja sen aromaattisen renkaan sisällä on kovalenttisia sidoksia. Silti sanotaan6H5Kujertaa- Naa+.
Orgaanisissa yhdisteissä hiiliatomien väliset kovalenttiset sidokset ovat vallitsevia
Tai mikä on sama sanottava: Orgaaniset yhdisteet koostuvat hiilihapotettuista luurankoista. Niissä on useampi kuin yksi C-C- tai C-H-sidos, ja tämä luuranko voi olla lineaarinen, dreare tai haarautunut, vaihteleen niiden tyydyttymättömyyden ja substituentin tyypin suhteen (heteroaátomos tai funktionaaliset ryhmät). Sokerissa, C-C, C-H ja C-OH-yhteydet ovat runsaasti.
Se voi palvella sinua: Agentin vähentäminen: Konsepti, vahvin, esimerkitLaitetaan esimerkki CO, ch2Kisko2 ja h2C2JOMPIKUMPI4. Mitkä näistä kolmesta yhdisteestä ovat epäorgaanisia?
CH: ssa2Kisko2 (Etyleenidioksidi) On neljä C-H-sidosta ja kaksi C-O-linkkiä, kun taas H: ssä2C2JOMPIKUMPI4 (Oksaalihappo) On yksi C-C, kaksi c-OH ja kaksi c = o. H: n rakenne2C2JOMPIKUMPI4 Se voidaan kirjoittaa HOOC-COOH: na (kaksi linkitettyä karboksyyliryhmää). Samaan aikaan CO koostuu molekyylistä, jota yleensä esitetään hybridisidoksella C = O: n ja C päin.
Koska CO: ssa (hiilimonoksidi) on vain hiiliatomi, joka on kytketty yhteen happea, tämä kaasu on epäorgaaninen; Muut yhdisteet ovat orgaanisia.
Orgaanisilla yhdisteillä on yleensä suurempia molaarimassoja
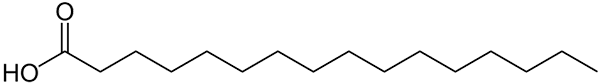 Rakenne, jota esitetään palmitiinihappolinjoilla. Suuri asia, jota verrataan pienempiin epäorgaanisiin yhdisteisiin tai sen suolojen kaavapaino voidaan havaita. Lähde: Wolfgang Schaefer [julkinen alue]
Rakenne, jota esitetään palmitiinihappolinjoilla. Suuri asia, jota verrataan pienempiin epäorgaanisiin yhdisteisiin tai sen suolojen kaavapaino voidaan havaita. Lähde: Wolfgang Schaefer [julkinen alue] Näistä säännöistä on jälleen lukuisia poikkeuksia, mutta yleensä orgaanisilla yhdisteillä on yleensä suurempia molaarimassoja niiden hiilihapotettujen luurankojen takia.
Esimerkiksi yllä olevien yhdisteiden molaarit ovat: 28 g/mol (CO), 90 g/mol (H2C2JOMPIKUMPI4) ja 60 g/mol (valitse2Kisko2-A. Tietysti CS2 (Hiilidisulfidi), epäorgaaninen yhdiste ja jonka molaarimassa on 76 g/mol, "painaa" enemmän kuin CHO2Kisko2.
Mutta entä rasvat tai rasvahapot? Biomolekyylejä, kuten DNA tai proteiineja? Tai laajoista lineaarisista ketjuhiilivedyistä? Tai asfalteeni? Sen molaarimassa ylittää helposti 100 g/mol. Esimerkiksi palmitiinihapolla (ylempi kuva) on 256 g/mol molaarinen taikina.
Orgaanisia yhdisteitä on runsaammin lukumäärä
Jotkut epäorgaaniset yhdisteet, joita kutsutaan koordinaatiokomplekseiksi, esittävät isomeíaa. Tämä on kuitenkin vähemmän monipuolista verrattuna orgaaniseen isomeriaan.
Vaikka lisäämme kaikki suolat, oksidit (metalliset ja ei -metalliset), sulfidit, telururot, karbidit, hydridit, nitridit jne., Emme kerää ehkä edes puolet luonnossa olevista orgaanisista yhdisteistä. Siksi orgaanisia yhdisteitä on runsaampia ja rakenteita rikkaampia.
Epäorgaaniset yhdisteet ovat alkeellisempia
Alkeishallinnon monimuotoisuuden mukaan epäorgaaniset yhdisteet ovat kuitenkin monimuotoisempia. Koska? Koska käden jaksollisen taulukon kanssa voit rakentaa minkä tahansa tyyppisen epäorgaanisen yhdisteen; kun taas orgaaninen yhdiste on rajoitettu vain elementteihin: C, H, O, P, S, N ja X (Halogeenit).
Meillä on monia metalleja (alkali, alkalinerit, siirtymä, lantanidit, aktiinidit, lohkon P) ja vaihtoehtojen äärettömyydet yhdistää ne useisiin anioneihin (tavallinen epäorgaaninen); kuten: CO32- (Karbonaatit), Cl- (Kloridit), p3- (fosfurot) tai2- (oksidit), OH- (hydroksidit), niin42- (sulfaatit), CN- (syanidit), SCN- (Tiocianaatit) ja monet muut.
Huomaa, että CN -anionit- ja SCN- Ne näyttävät olevan orgaanisia, mutta ne ovat todella epäorgaanisia. Toinen sekaannus on oksalaattianioni, c2JOMPIKUMPI42-, joka on orgaanista ja ei -inorgaanista.
Voi palvella sinua: diagonaalinen sääntöEpäorgaanisilla yhdisteillä on korkeampi fuusio- ja kiehumispisteet
Jälleen on olemassa useita poikkeuksia tästä säännöstä, koska kaikki riippuu siitä, mitä yhdisteitä verrataan. Epäorgaanisiin ja orgaanisiin suoloihin tarttuminen entisellä on kuitenkin yleensä suurempia fuusio- ja kiehumispisteitä kuin jälkimmäisissä.
Täältä löytyy toinen implisiittinen kohta: orgaaniset suolat ovat alttiita hajoamiselle, koska lämpö katkaisee sen kovalenttiset sidokset. Silti vertaamme kalsiumtartrato par (CAC4H4JOMPIKUMPI6) ja kalsiumkarbonaatti (Caco3-A. CAC4H4JOMPIKUMPI6 Se hajoaa 600 ° C: ssa, kun taas Caco3 Se sulaa 825 ° C: ssa.
Ja että caco3 ei ole kaukana yksi suoloista, joilla on korkeimmat sulamispisteet, kuten CAC: n tapauksessa2 (2160 ºC) ja CAS2 (2525 ºC): Kuullu ja kalsiumsulfidi, vastaavasti.
Orgaaniset yhdisteet ovat harvinaisempia maailmankaikkeudessa
Yksinkertaisimmat ja primitiivisimmät orgaaniset yhdisteet, kuten metaani, Cho4, Urea, co (NH2-A2, tai aminohappoglycina, NH2CH2COOH, ovat erittäin harvinaisia lajeja kosmoksissa verrattuna ammoniakkiin, hiilidioksidiin, titaanioksideihin, hiilen jne. Universumissa edes elämän edeltäviä materiaaleja ei usein havaita.
Orgaaniset yhdisteet tukevat elämää paljon enemmän kuin epäorgaaniset
 Morrocoyn kuori koostuu keratiinin peittämästä luiden seoksesta, joka koostuu epäorgaanisesta matriisista (hydroksiapatiitista ja niihin liittyvistä mineraaleista) ja orgaanisesta (kollageeni, rusto ja hermot). Lähde: Morrocoy_ (Geochelone_Carbonary).JPG: Valokuvaus.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Morrocoyn kuori koostuu keratiinin peittämästä luiden seoksesta, joka koostuu epäorgaanisesta matriisista (hydroksiapatiitista ja niihin liittyvistä mineraaleista) ja orgaanisesta (kollageeni, rusto ja hermot). Lähde: Morrocoy_ (Geochelone_Carbonary).JPG: Valokuvaus.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Hiilikemiasta, orgaanista, jota käytetään metabolisten prosessien ymmärtämisessä, tulee biokemia (ja metallikationien näkökulmasta bioinorgaanisesti).
Orgaaniset yhdisteet ovat elämän kulmakivi (kuten ylemmän kuvan morrokoy) C-C-linkkien ja näiden linkkien aiheuttamien rakenteiden valtavan ryhmittymän ansiosta ja sen vuorovaikutuksesta epäorgaanisten suolojen kiteiden kanssa.
Palattuaan sokeripariin, luonnolliset sokerilähteet ovat elossa: ne ovat kasveja, jotka kehittyvät ja kuolevat; Mutta se ei tapahdu samalla tavalla suolan lähteiden kanssa: meret tai suolaliuoksen kerrostumat ovat elossa (fysiologisessa mielessä).
Kasvit ja eläimet syntetisoivat loputtomia orgaanisia yhdisteitä, jotka integroivat laajan valikoiman luonnollisia tuotteita (vitamiineja, entsyymejä, hormoneja, rasvoja, väriaineita jne.-A.
Emme kuitenkaan voi jättää pois sitä tosiasiaa, että vesi on elämän liuotin (ja on epäorgaanista); Eikä se happi ole välttämätöntä solujen hengitykselle (ilman metallikofaktoreita, jotka eivät ole epäorgaanisia yhdisteitä, mutta kationeja). Siksi epäorgaanisella on myös tärkeä rooli elämän määritelmässä.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. Amiini. (10. painos.-A. Wiley Plus.
- Helmestine, Anne Marie, PH.D -d. (3. heinäkuuta 2019). Ero orgaanisen ja epäorgaanisen välillä. Toipunut: Admingco.com
- Texas Education Agency. (2019). Orgaaninen tai epäorgaaninen? Toipunut: Texasgateway.org
- Sakkaroosi. (S.F.-A. Kuinka sokeria tehdään: Johdanto. Toipunut: SUCROSA.com
- Wikipedia. (2019). Luettelo epäorgaanisista yhdisteistä. Haettu: vuonna.Wikipedia.org
- « Erot nopeuden ja nopeuden välillä (esimerkkien kanssa)
- 10 emotionaalinen älykkyysdynamiikka lapsille ja aikuisille »

