Elektrofiilireaktiot, esimerkit, elektrofiilisyys
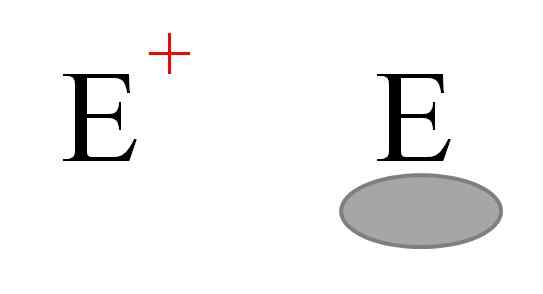
- 3297
- 1048
- Juan Breitenberg V
Eräs Elektrofiili Kemialliset lajit (atomi tai molekyyli) näyttää innokkaasti pari elektronia. Sana tarkoittaa 'Rakkaus elektroneihin'. Siksi sähköfyllissä on aina taipumus voittaa tai hyväksyä elektroneja osallistuessaan kemiallisiin reaktioihin.
Mikä tekee elektroneja tarvitsevan elektrofiilin? Sinulla on oltava elektronien puute, riippumatta siitä, ilmenee osittaisella tai kokonaispositiivisella kuormituksella tai epätäydellisen valenssiokteetin elektronisella avoimella avoimella tuotteella. Eli meillä on monentyyppisiä elektrofiilejä, vaikka ne kaikki hyväksyvät negatiivisten lajien elektroniparit.
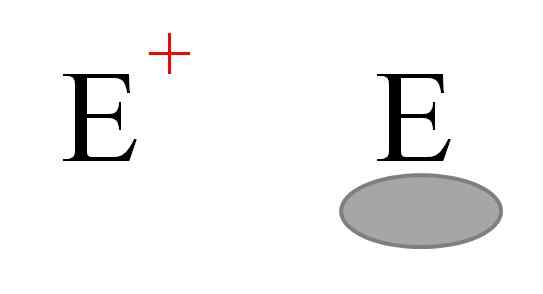 Kemian kaksi yleisintä elektrofiiliä. Lähde: Gabriel Bolívar.
Kemian kaksi yleisintä elektrofiiliä. Lähde: Gabriel Bolívar. Kaksi tyyppiä elektrofiilejä on yleensä edustettuna. Molemmat symboloivat kirjaimella ja. Vasemmalla puolella vastaa positiivista kuormitusta ja+. Samaan aikaan oikealla oleva vastaa elektrofiilia, jolla on elektroninen avoin työpaikka, jota edustaa harmahtava soikea, joka osoittaa elektronien puuttumisen Valencian kiertoradalla.
Metallikationit ovat esimerkkejä elektrofiileistä ja+, samoin kuin joitain polyiatomisia ioneja, kuten hydronium, H3JOMPIKUMPI+. Alhin molekyylit3 ja bf3, Toisaalta ne ovat esimerkkejä toisen tyyppisistä elektrofiileistä, koska sekä alumiini- että booriatomilla on elektronien puute, koska ne eivät täytä Valencian oktettia.
[TOC]
Reaktiot
Elektrofiilit reagoivat hyväksymällä atomielektroniparit, joilla on korkea negatiivinen tiheys, ts. Elektronirikas. Näitä negatiivisia atomeja tai molekyylejä kutsutaan nukleofiileiksi, NU-, jotka lahjoittavat pari elektronia sähkösuhteelle ja e e+-
Gnuu- + JA+ → nu-e
Tämä on teoreettinen perusta monille orgaanisille reaktioille, kuten aromaattiset elektrofiiliset substituutiot. Nukleofiilin ei välttämättä tarvitse olla anioni, mutta se voi olla myös neutraali molekyyli, jolla on elektronegatiivinen atomi, kuten typpi.
Voi palvella sinua: pii: historia, ominaisuudet, rakenne, hankkiminen, käyttöEsimerkkejä elektrofiileistä
Lewis -hapot
Lewis -hapot ovat elektrofiilejä, koska määritelmän mukaan ne hyväksyvät elektroniparit. Metalliset kationit, mn+, Houkuttele ympäröivien polaaristen molekyylien negatiivisia alueita solvaatioissa. Siten mn+ päätyy ympäröiviin negatiivisiin kuormiin, jopa hyväksymään elektroneja koordinaatiokompleksien muodostamiseksi.
Cucion cu2+, Esimerkiksi se on Lewis -happo ja elektrofiili, koska se on koordinoitu veden happeatomien kanssa kompleksin ACU: n muodostamiseksi2-A62+. Samalla tavalla se tapahtuu muiden kationien kanssa.
Kaikki Lewis -hapot eivät ole kationeja: jotkut ovat neutraaleja molekyylejä tai atomeja. Esimerkiksi BF3 Se on Lewis -happo ja elektrofiili, koska.
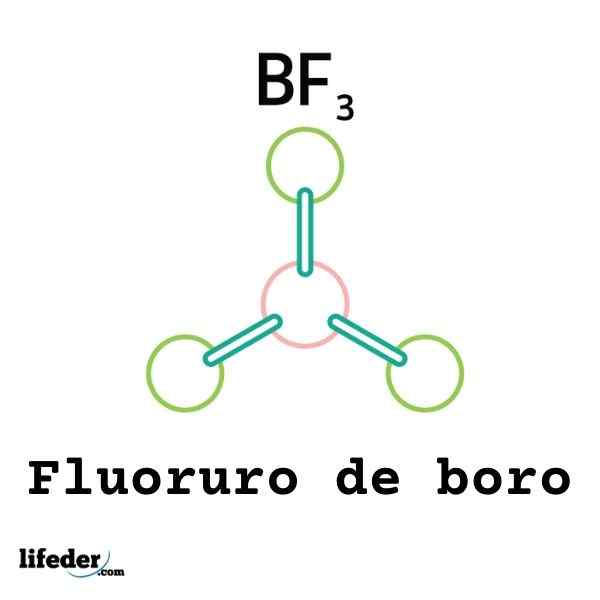
Siten se yhdistetään ympäröivään fluori -anioniin muodostamaan boro tetrafluori -anionin, bf4-. Eli bf3 muodostaa yhteyden f: n kanssa- Hyväksymällä pari heidän elektronia.
Toinen sähköfy on nitronio -ioni, ei2+, joka on Elektrofyyliaine erittäin vahva muodostettu bentseenin nitraatioreaktioissa. Tässä ionissa typpiatomilla on positiivinen kuorma, joten bentseenielektronit hyväksyvät nopeasti.
Brönsted -hapot
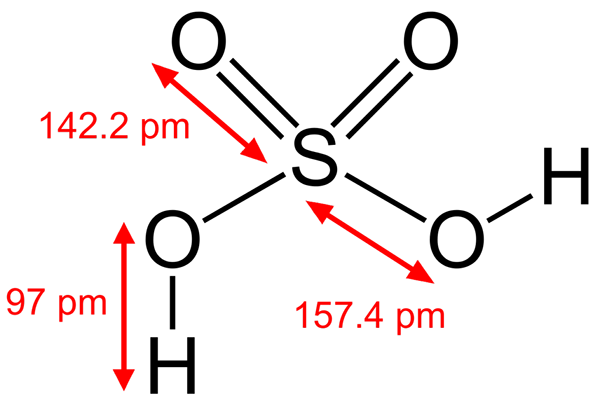 Rikkihapporakenne
Rikkihapporakenne Jotkut Brönsted -hapot ovat myös elektrofiilejä. Esimerkiksi hydroniumkation, H3JOMPIKUMPI+, Se on elektrofiili, koska happiatomilla on positiivinen kuorma. Koska olet erittäin elektronegatiivinen, pyrit saamaan elektroneja, jotka luovuttavat yhden sen hydrogeista muuttumaan vesimolekyyliksi.
Toinen Brönsted -happo, kuten rikkihappo, H2Sw4, Se on myös elektrofiili. Rikkiatomi on erittäin hapettunut ja pyrkii saamaan elektroneja, jotka luovuttavat sen kaksi vety.
Voi palvella sinua: hiilitetrakloridi (CCL4)Halogeenit
Halogeenit (f2, Cl2, Br2 ja minä2) Ne ovat elektrofiilejä. Sen atomeilla ei ole sähköisiä puutteita; Niiden linkit ovat kuitenkin epävakaita, koska molemmat atomit, X-X, houkuttelevat heihin erittäin voimakkaasti elektroneja.
Siksi halogeenit reagoivat hapettavina aineina, käyttäytyvät elektrofiileinä ja hyväksymällä elektronipareiksi tullaksesi halogenidianioneiksi (F-, Cl-, Br- ja minä--A.
Halogeenit eivät kuitenkaan vain voita elektroneja tällä tavalla. Ne voidaan kytkeä myös vähemmän elektronegatiivisiin atomeihin kuin ne, jotta saadaan nettoelektronien vahvistukset. Esimerkiksi tämä on syy siihen, miksi ne voidaan lisätä alkeenien tai olefiinien kaksoissidoksiin.
Halogeenit edustavat erityyppistä elektrofiaa kuin kaksi, jotka otettiin käyttöön alussa. Sen käyttäytyminen lopussa on kuitenkin sama kuin kaikille elektrofiileille: Hyväksy elektroniparit.
Vuokra- ja vetyhalogenidit
 CFC -molekyylit ovat alkyylihalogenideja
CFC -molekyylit ovat alkyylihalogenideja Vuokra- ja vetyhalogenidit ovat elektrofiilejä, joissa halogeeni -kytketty atomilla on vahva elektroninen puute, jota edustaa Δ -symboli+. Tämä johtuu siitä, että halogeeni, erittäin elektronegatiivinen, houkuttelee naapuriatomin elektronista tiheyttä itselleen.
Alkyylihalogenideissa RX, R: llä on elektroninen puute, kun taas x ylimääräiset elektronit, RΔ+-XΔ-. Siten, jos erittäin negatiivinen laji lähestyy RX: tä, se hyökkää r yhteyteen siihen ja saada x tulemaan anioniksi.
Myös vetyhalogensseissa HX, vety on elektroninen puute tai positiivinen osittainen kuorma, HΔ+-XΔ-. Siksi negatiiviset lajit tuottavat elektronit tähän vetyyn ja hän hyväksyy ne elektrofiilinä.
Karbonyyliyhdisteet
Hapot, halogeenit ja halogenidit eivät ole ainoita molekyylejä, jotka voidaan luokitella elektrofiileiksi. Vaikka ei, hiilidioksidi, Co2, Se on elektrofiili, koska keskus hiiliatomi on hyvin hapettunut, tai = cΔ+= O.
Voi palvella sinua: tasainen taustapulloSiksi, kun CO -2 Reacta tekee sen vastaanottaen elektroniparit, joko tulossa karboksylaatti, COOH -ryhmä tai karbonaatti -anioniksi, CO32-.
CO: n lisäksi2, Karbonyyliyhdisteet, kuten ketonit, aldehydit ja esterit, ovat myös esimerkkejä elektrofiileistä, koska niissä hiilellä on positiivinen osittainen kuormitus ja pyrkii hyväksymään erittäin negatiivisten lajien elektroneja.
Karbokaatiot
 Metaanihiiliatomi positiivisesti ladattu
Metaanihiiliatomi positiivisesti ladattu Karbokaatiot ovat poikkeuksellisen vahvoja Lewis -happoja. On tertiääriä (r3C+), toissijainen (r2HC+) tai ensisijainen (RH2C+-A. Hiili muodostaa aina neljä sidosta, joten erityisesti tämä kationi pyrkii hyväksymään elektronit millään tavalla.
Elektrofiilisyys
Kaikki elektrofiilit eivät ole yhtä "nälkäisiä" elektroneja. Jotkut ovat reaktiivisempia kuin toiset. Mitä suurempi elektroninen elektrofiilin puute, sitä suurempi sen herkkyys kärsivät negatiivisten lajien nukleofiilisistä hyökkäyksistä. Toisin sanoen se esiintyy suuremman elektrofyylillisyyden, mikä on suhteellinen mitta siitä, kuinka reaktiivinen on kyseinen elektrofiili.
Esimerkiksi hiileillä, nitroniumilla ja fluoridilla on korkea elektrofylaatio; Vaikka hiilidioksidi tai joillakin kationeilla, kuten natriumilla.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Morrison, r. T. ja Boyd, R, N. (1987). Orgaaninen kemia. 5. painos. Toimituksellinen Addison-Wesley Inter-American.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. (10. painos.-A. Wiley Plus.
- Wikipedia. (2020). Elektrofiili-. Haettu: vuonna.Wikipedia.org
- James Ashenhurst. (2020). Nukleofiilit ja elektrofiilit. Toipunut: MasterorganicChemistry.com
- Professori Patricia Shaley. (2012). Nukleofiilit ja elektrofiilit. Illinoisin yliopisto. Toipunut: butaani.Kemia.Uic.Edu
- Danielle Reid. (2020). Elektrofiili: Määritelmä ja esimerkki. Opiskelu. Toipunut: Opiskelu.com
- Tim Soderberg. (7. lokakuuta 2019). Elektrofiilit. Kemian librettexts. Palautettu: Chem.Librettexts.org
- « Biot-Savart Law Formula, esittely, sovellukset, harjoitukset
- Shelfordin suvaitsevaisuuslaki, joka koostuu ja esimerkkejä »

