Lewis -rakenne, mistä se koostuu, miten se tehdään, esimerkkejä

- 3539
- 828
- Gustavo Runte DVM
Se Lewis -rakenne Se on kaikki kovalenttisten sidosten esitys molekyylissä tai ionissa. Siinä nämä sidokset ja elektronit ovat edustettuina pitkillä pisteillä tai skripteillä, vaikka suurimman osan ajasta pisteet vastaavat jaettuja elektroneja ja skriptejä kovalenttisiin sidoksiin.
Mutta mikä on kovalenttinen linkki? Se on parin elektronien (tai pisteiden) jakaminen jaksollisen taulukon kahden atomin välillä. Näillä kaavioilla voit luonnostella monia luurankoja tietylle yhdisteelle. Mikä niistä on oikea, riippuu samojen atomien muodollisista kuormista ja kemiallisesta luonteesta.
 2-bromopropaaniyhdiste. Ben Million [julkinen alue], Wikimedia Commons.
2-bromopropaaniyhdiste. Ben Million [julkinen alue], Wikimedia Commons. Ylivoimaisessa kuvassa on esimerkki siitä, mikä Lewis -rakenne on. Tässä tapauksessa edustama yhdiste on 2-bromopropano. Elektroneja vastaavat mustat kohdat ovat nähtävissä, sekä linkkeihin osallistuvat että ne, joita ei jaettu (ainoa vääntömomentti juuri BR: n yläpuolella).
Jos pistepisteet ":" korvattiin pitkällä käsikirjoituksella "-", niin 2-bromopropanon hiili luuranko esitetään seuraavasti: C-C-C. Miksi "molekyylikehys" piirretty, voisiko se olla C-H-C? Vastaus on kunkin atomin sähköiset ominaisuudet.
Siten, koska vedyssä on vain yksi elektroni ja yksi kiertorata, joka on käytettävissä, vain kovalenttinen sidos. Siksi et voi koskaan muodostaa kahta sidosta (älä sekoita vety silloilla). Toisaalta hiiliatomin elektroninen kokoonpano mahdollistaa (ja vaatii) neljän kovalenttisen sidoksen muodostumisen.
Tästä syystä Lewisin rakenteiden, joissa C: n ja H: n on oltava johdonmukaisia, ja kunnioitettava sitä, mitä niiden sähköiset kokoonpanot säätelevät. Tällä tavoin, jos hiilellä on enemmän kuin neljä sidosta tai vetyä enemmän kuin yksi, luonnos voidaan sulkea pois ja aloittaa uusi enemmän todellisuuden mukaisesti.
Juuri täällä esiintyy joitain näiden rakenteiden tärkeimmistä syistä tai selkänojista, jotka Gilbert Newton Lewis esittelivät kokeelliselle tiedolle uskollisia molekyyliesityksiä: molekyylirakenne ja muodolliset kuormat.
Kaikkia olemassa olevia yhdisteitä voi edustaa Lewis -rakenteet, mikä antaa ensimmäisen lähestymistavan siihen, kuinka molekyyli tai ionit voisivat olla.
[TOC]
Mikä on Lewisin rakenne?
Se on Valencia -elektronien ja kovalenttisten sidosten edustava rakenne molekyylissä tai ionissa, jolla on käsitys sen molekyylirakenteesta.
Tämä rakenne ei kuitenkaan ennusta joitain tärkeitä yksityiskohtia, kuten molekyyligeometriaa atomin ja sen ympäristön suhteen (jos se on neliömäistä, litteää, bipiramidaalista jne.-A.
Se ei myöskään sano mitään sen atomien kemiallisen hybridisaation suhteen, mutta missä kaksinkertaiset tai kolminkertaiset sidokset sijoitetaan ja jos rakenteessa on resonanssia.
Näiden tietojen avulla voit väittää yhdisteen reaktiivisuudesta, sen stabiilisuudesta, kuinka ja mitä mekanismia molekyyli seuraa reagoiessaan.
Tästä syystä Lewisin rakenteet eivät koskaan lopeta harkitsemista ja ovat erittäin hyödyllisiä, koska ne voivat tiivistää uuden kemiallisen oppimisen.
Kuinka se tehdään?
Rakenteen, kaavan tai Lewis -kaavion piirtämiseksi tai luonnostelemiseksi yhdisteen kemiallinen kaava on välttämätön. Ilman sitä et voi edes tietää, mitkä ovat atomit, jotka tekevät siitä. Kerran sen kanssa jaksollista taulukkoa käytetään paikantamaan, mitkä ryhmät kuuluvat.
Voi palvella sinua: viskositeetti: esimerkkejä, syitä, yksiköitä, tyyppejäEsimerkiksi, jos sinulla on yhdiste C14JOMPIKUMPI2N3 Sitten meidän on etsittävä ryhmiä, joissa hiili, happi ja typpi ovat. Tehty tämä yhdisteestä riippumatta valenssielektronien lukumäärä pysyy samana, niin ennemmin tai myöhemmin he muistavat.
Siten hiili kuuluu arvonlisäveroon, happea Via -ryhmään ja typpi VA: lle. Ryhmänumero on yhtä suuri kuin Valencian elektronien määrä (pisteet). Kaikilla heillä on yhteinen taipumus suorittaa Valencia -kerroksen oktetti.
Mikä on oktettisääntö?
Tämä sanoo. Tämä pätee kaikkiin ei -metallisiin elementteihin tai jaksollisen taulukon lohkoista S tai P.
Kaikki elementit eivät kuitenkaan noudata oktettisääntöä. Erityiset tapaukset ovat siirtymämetalleja, joiden rakenteet perustuvat enemmän muodollisiin kuormituksiin ja niiden ryhmänumeroon.
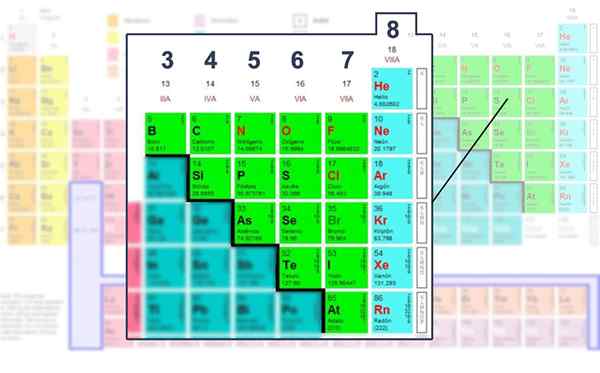 Ei -metallisien elementtien Valencia -kerroksen elektronien lukumäärä, ne, joissa sitä voidaan käyttää Lewis -rakenteella.
Ei -metallisien elementtien Valencia -kerroksen elektronien lukumäärä, ne, joissa sitä voidaan käyttää Lewis -rakenteella. Matemaattisen kaavan soveltaminen
Tietäen, mikä ryhmä elementtejä kuuluu, ja siksi linkkien muodostamiseen käytettävissä olevien valenssielektronien lukumäärä on seuraava kaava, mikä on hyödyllistä Lewisin rakenteiden piirtämisessä:
C = n - d
Missä C tarkoittaa jaetut elektronit, eli ne, jotka osallistuvat kovalenttisiin joukkovelkakirjoihin. Koska jokainen linkki koostuu kahdesta elektronista, sitten C/2 on yhtä suuri kuin linkkien (tai skriptien) lukumäärä, jotka on piirrettävä.
N ovat välttämättömät elektronit, Ne, joilla on oltava atomi sen Valencia -kerroksessa, olla isolektroninen jalokaasuun, joka seuraa samalla ajanjaksolla. Kaikille muille elementeille kuin H (koska se vaatii kaksi elektronia verratakseen häntä) he tarvitsevat kahdeksan elektronia.
D ovat Saatavilla olevia elektroneja, jotka määritetään Valencian ryhmä- tai elektronien lukumäärän mukaan. Siten, koska CL kuuluu ryhmään VIIA, sitä on ympäröimä seitsemän mustaa tai elektronia, ja muista, että paria tarvitaan linkin muodostamiseksi.
Atomit, niiden pisteet ja linkkien lukumäärä c/2, Lewis -rakenne voidaan sitten improvisoida. Mutta lisäksi on tarpeen saada käsitys muista "säännöistä".
Mihin sijoittaa vähemmän elektronegatiivisia atomeja
Vähemmän elektronegatiiviset atomit valtaosassa rakenteista miehittää keskukset. Tästä syystä, jos sinulla on yhdiste, jolla on atomeja P, O ja F, P: n on siksi oltava hypoteettisen rakenteen keskellä.
On myös tärkeää korostaa, että hydrogens on yleensä kytketty erittäin elektronegatiivisiin atomiin. Jos sinulla on Zn-, H- ja O-yhdisteessä, H menee O: n viereen eikä Zn: n (Zn-O-H ja H-Zn-O) kanssa. Tästä säännöstä on poikkeuksia, mutta tapahtuu yleensä ei -metallisilla atomilla.
Symmetria ja muodolliset kuormat
Luonnolla on suuri mieluummin aiheuttaa molekyylirakenteita mahdollisimman symmetrisiä. Tämä auttaa välttämään epäjärjestysrakenteiden kasvattamista, atomit on järjestetty siten, että ne eivät noudata mitään näkyvää mallia.
Se voi palvella sinua: happobassiteoriat: Arrhenius, Bronsted-Lowry, LewisEsimerkiksi yhdisteelle C2-Lla3, Jos A on kuvitteellinen atomi, todennäköisin rakenne olisi A-C-A-C-A. Huomaa heidän sivujensa symmetria, molemmat heijastukset toisesta.
Muodollisilla kuormituksilla on myös tärkeä rooli piirtäessään Lewisin rakenteita, etenkin ioneille. Siten linkit voidaan lisätä tai poistaa siten, että atomin muodollinen kuormitus vastaa näytettyä kokonaiskuormaa. Tämä kriteeri on erittäin hyödyllinen siirtymämetalliyhdisteille.
Octet -säännön rajoitukset
 Alumiinitrifluoridiesitys, yhdiste, joka on epävakaa. Molemmat elementit koostuvat kuudesta elektronista, jotka tuottavat kolme kovalenttia sidosta, kun niiden tulisi olla kahdeksan stabiilisuuden saavuttamiseksi. Lähde: Gabriel Bolívar
Alumiinitrifluoridiesitys, yhdiste, joka on epävakaa. Molemmat elementit koostuvat kuudesta elektronista, jotka tuottavat kolme kovalenttia sidosta, kun niiden tulisi olla kahdeksan stabiilisuuden saavuttamiseksi. Lähde: Gabriel Bolívar Kaikkia sääntöjä ei täytetä, mikä ei välttämättä tarkoita, että rakenne on väärä. Tyypillisiä esimerkkejä tästä havaitaan monissa yhdisteissä, joissa ryhmän IIIA elementtejä (B, Al, Ga, IN, TL). Tässä pidetään erityisesti alumiini -trifluoruro (ALF3-A.
Sitten yllä kuvatun kaavan soveltaminen, sinulla on:
D = 1 × 3 (alumiiniatomi) + 7 × 3 (kolme fluoriatomia) = 24 elektronia
Täällä 3 ja 7 ovat vastaavia ryhmiä tai valenssielektronien lukumääriä, jotka ovat saatavana alumiinille ja fluorille. Sitten ottaen huomioon tarvittavat elektronit n:
N = 8 × 1 (alumiiniatomi) + 8 × 3 (kolme fluoriatomia) = 32 elektronia
Ja siksi jaetut elektronit ovat:
C = n - d
C = 32 - 24 = 8 elektronia
C/2 = 4 linkkiä
Koska alumiini on vähiten elektronegatiivinen atomi, se on asetettava keskelle ja fluori muodostaa vain linkin. Kun otetaan huomioon, sinulla on Lewis del Alf -rakenne3 (Yläkuva). Jaetut elektronit korostetaan vihreillä pisteillä, jotta ne voidaan erottaa verrattomasta.
Vaikka laskelmat ennustavat, että on olemassa 4 linkkiä, jotka on muodostettava, alumiinista puuttuu riittävästi elektroneja, eikä myöskään neljäs fluoriatomia ole. Seurauksena on, että alumiini ei noudata oktettisääntöä, ja tämä tosiasia ei heijastu laskelmissa.
Lewis -rakenteet esimerkkejä
Jodi
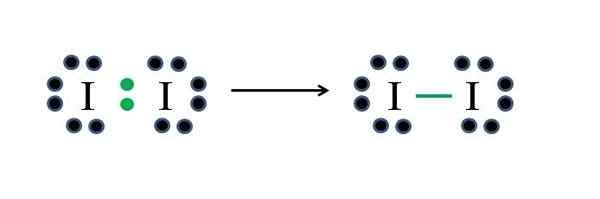 Joo -ei -metalleilla on seitsemän elektronia, joten jakamalla yksi näistä elektroneista ne tuottavat kovalenttisen sidoksen, joka antaa heille stabiilisuuden. Lähde: Gabriel Bolívar
Joo -ei -metalleilla on seitsemän elektronia, joten jakamalla yksi näistä elektroneista ne tuottavat kovalenttisen sidoksen, joka antaa heille stabiilisuuden. Lähde: Gabriel Bolívar Jodi on halogeeni ja kuuluu siksi ryhmälle VIIA. Sitten siinä on seitsemän Valencian elektronia, ja tämä yksinkertainen diatominen molekyyli voidaan edustaa improvisoimaan tai soveltamaan kaavaa:
D = 2 × 7 (kaksi jodiatomia) = 14 elektronia
N = 2 × 8 = 16 elektronia
C = 16 - 14 = 2 elektronia
C/2 = 1 linkki
Koska 14 elektronia 2 osallistuu kovalenttiseen sidokseen (vihreät pisteet ja komentosarjat), 12 ei ole jaettu; Ja koska ne ovat kaksi jodiatomia, 6 on jaettava yhdelle heistä (niiden valenssielektronit). Tässä molekyylissä vain tämä rakenne on mahdollista, jonka geometria on lineaarinen.
Ammoniakki
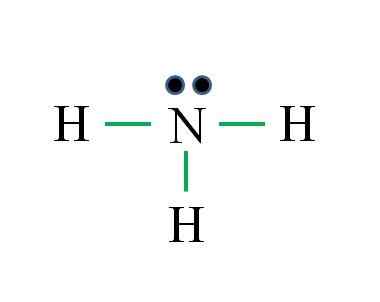 Typpellä on 5 elektronia, kun taas vety vain 1. Riittävä stabiilisuuden saavuttamiseksi, kun muodostetaan kolme kovalenttista sidosta, jotka koostuvat N: n elektronista ja toisesta H -lähteestä: Gabriel Bolívar
Typpellä on 5 elektronia, kun taas vety vain 1. Riittävä stabiilisuuden saavuttamiseksi, kun muodostetaan kolme kovalenttista sidosta, jotka koostuvat N: n elektronista ja toisesta H -lähteestä: Gabriel Bolívar Mikä on Lewisin ammoniakkimolekyylin rakenne? Koska typpi on VA -ryhmästä, siinä on viisi Valencian elektronia, ja sitten: sitten:
Se voi palvella sinua: laboratoriolämpömittari: Ominaisuudet, mitä se on, käytä, esimerkkejäD = 1 × 5 (typpiatomi) + 1 x 3 (kolme vetyatomia) = 8 elektronia
N = 8 × 1 + 2 × 3 = 14 elektronia
C = 14 - 8 = 6 elektronia
C/2 = 3 linkkiä
Tällä kertaa kaava on oikea linkkien lukumäärä (kolme vihreää linkkiä). Sidosten osallistumisen 8 käytettävissä olevasta elektronista 6 lähtien typpiatomin yläpuolella sijaitseva ei -jaettuja vääntömomentti.
Tämä rakenne kertoo kaiken, mikä tulisi tietää ammoniakkipohjasta. TEV: n ja TRPEV: n tiedon soveltamisessa seuraa, että geometria on tetraedrinen vääristynyt vapaa typpimomentti ja että tämän hybridisaatio on siksi SP3.
C2H6JOMPIKUMPI
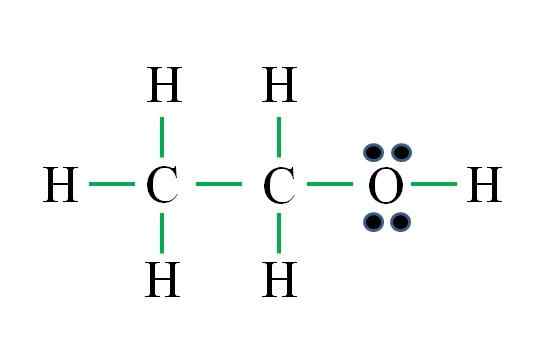 Lähde: Gabriel Bolívar
Lähde: Gabriel Bolívar Kaava vastaa orgaanista yhdistettä. Ennen kaavan levittämistä on muistettava, että hydrogenit muodostavat yhden sidoksen, happea kaksi, hiili neljä ja että rakenteen on oltava mahdollisimman symmetrinen. Edellisten esimerkkien jatkaminen on:
D = 6 × 1 (kuusi vetyatomia) + 6 x 1 (happiatomi) + 4 x 2 (kaksi hiiliatomia) = 20 elektronia
N = 6 × 2 (kuusi vetyatomia) + 8 x 1 (happiatomi) + 8 x 2 (kaksi hiiliatomia) = 36 elektronia
C = 36 - 20 = 16 elektronia
C/2 = 8 linkkiä
Vihreiden skriptien lukumäärä vastaa 8 laskettua linkkiä. Ehdotettu Lewis -rakenne on etanolin CH3CH2vai niin. Olisi kuitenkin ollut oikein ehdottaa dimetyylieetterin rakennetta3Kisko3, mikä on vielä symmetristä.
Mikä kahdesta on "enemmän" oikeaa? Molemmat ovat yhtäläisiä, koska rakenteet syntyivät saman molekyylisen kaavan C rakenteellisina isomeereinä2H6JOMPIKUMPI.
Permanganaatti -ioni
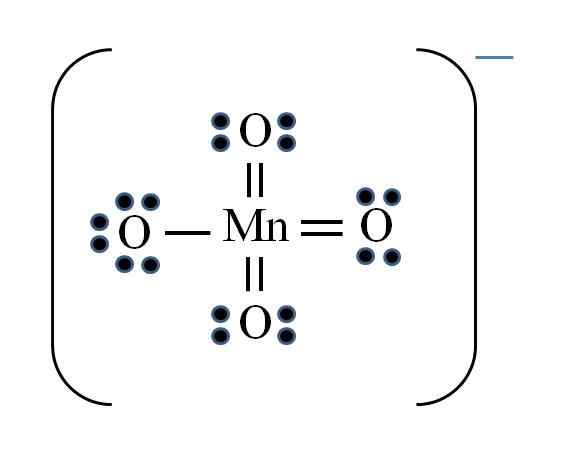 Lähde: Gabriel Bolívar
Lähde: Gabriel Bolívar Tilanne on monimutkainen, kun haluat tehdä Lewis -rakenteita siirtymämetalliyhdisteille. Mangaani kuuluu myös VIIB -ryhmään, negatiivisen kuorman elektronia on lisättävä käytettävissä olevien elektronien joukkoon. Kaavan soveltaminen:
D = 7 × 1 (mangaaniatomi) + 6 × 4 (neljä happiatomia) + 1 elektroni kuormaa kohti = 32 elektronia
N = 8 × 1 + 8 × 4 = 40 elektronia
C = 40 - 32 = 8 Jaettu elektronia
C/2 = 4 linkkiä
Siirtymämetalleissa voi kuitenkin olla yli kahdeksan elektronia Valenciassa. Myös MNO -ionille4- Näyttää negatiivisen kuorman, on välttämätöntä vähentää happiatomien muodollisia kuormituksia. Kuten? Kaksoislinkkien kautta.
Jos kaikki MNO: n linkit4- Ne olivat yksinkertaisia, hapen muodolliset kuormat olisivat yhtä suuret kuin -1. Koska niitä on neljä, tuloksena oleva kuorma olisi -4 anionille, mikä ei selvästikään ole totta. Kun kaksoissidokset muodostuvat, on taataan, että yhdellä hapella on negatiivinen muodollinen kuorma, joka heijastuu ionissa.
Permanganaatti -ionissa voidaan nähdä, että resonanssia on. Tämä tarkoittaa, että ainoa yksinkertainen mn-o-linkki demokaalisoituu O: n neljän atomin välillä.
Dikromato -ioni
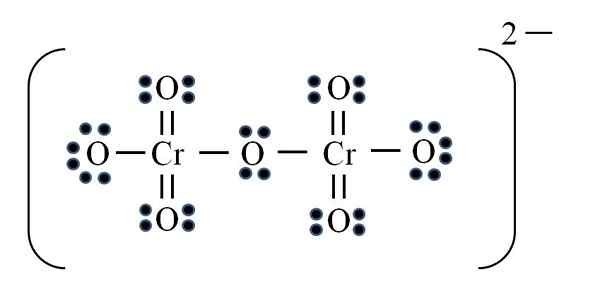 Lähde: Gabriel Bolívar
Lähde: Gabriel Bolívar Lopuksi tapahtuu samanlainen tapaus dicromato -ionin kanssa (CR2JOMPIKUMPI7-A. Kromi kuuluu VIB -ryhmään, joten siinä on kuusi Valencian elektronia. Kaavan soveltaminen uudelleen:
D = 6 × 2 (kaksi kromiatomia) + 6 × 7 (seitsemän happiatomia) + 2 elektronia kaksiarvoisella kuormalla = 56 elektronia
N = 8 × 2 + 8 × 7 = 72 elektronia
C = 72 - 56 = 16 jaettu elektronia
C/2 = 8 linkkiä
Mutta linkkejä ei ole 8, mutta 12. Samoista syistä löydetyistä syistä permanganaatti -ionissa kaksi happea on jätettävä negatiivisilla muodollisilla kuormilla, jotka lisäävät yhtä suureksi kuin -2, dicromato -ionin kuorma.
Siten niin monta kaksoislinkkiä lisätään tarpeen mukaan. Tällä tavoin saavutat kuvan Lewis -rakenteen CR: lle2JOMPIKUMPI72-.
Viitteet
- Whitten, Davis, Peck & Stanley. Kemia. (8. ed.-A. Cengage Learning, s. 251.
- Lewis -rakenteet. Otettu: Chemed.Kemia.Purduke.Edu
- Steven a. Hardinger, kemian ja biokemian laitos, UCLA. (2017). Lewis -rakenne. Otettu: Chem.UCLA.Edu
- Wayne Breslyn. (2012). Lewis -rakenteiden piirtäminen. Otettu: TerpConnect.Umd.Edu
- Verkkovastaava. (2012). Lewis ("Electron Dot") rakenteet. Kemian laitos, Maine University, Orono. Otettu: kemia.Umeche.Maine.Edu
- Lancaster, Sean. (25. huhtikuuta 2017). Kuinka määrittää, kuinka monta pistettä elementin Lewis Dot -rakenteessa on. Tiede. Toipunut: tiedekunnasta.com

