Yksiköt ioninen voima, kuinka laskea se, esimerkkejä

- 1408
- 130
- Alonzo Kirlin
Se ionivoima Se on tapa ilmaista ionien pitoisuus liuoksessa. Lewis ja Randall esittelivät tämän konseptin vuonna 1922 työskennellessään kemiallisen aktiivisuuskertoimen kuvauksen kanssa.
Kun ionien pitoisuus liuoksessa on korkea, tuotetaan sähköstaattinen vuorovaikutus vastakkaisten ionien välillä; Toisin sanoen kationit ja anionit houkuttelevat suuresti, mikä johtaa tehokkaaseen tai todelliseen ionipitoisuuteen on pienempi kuin tietylle kemialliselle reaktiolle laskettu.
 Meriveden ioninen voima on korkea, noin 0.7, sen suuren liuenneen suolan pitoisuuden vuoksi
Meriveden ioninen voima on korkea, noin 0.7, sen suuren liuenneen suolan pitoisuuden vuoksi Tästä syystä kemiallisen aktiivisuuden käsite otettiin käyttöön liuoksen tehokkaana ionisena pitoisuutena, kemiallinen aktiivisuus oli liuoksen molaarisuuden tuote kemiallisen aktiivisuuden kertoimella.
Tällä kertoimella on arvo, joka on lähellä yksikköä (1) laimennettuihin ionisiin liuoksiin ja niin kutsuttuihin ihanteellisiin ratkaisuihin. Nämä ovat liuoksia, joissa molekyylien välinen vuorovaikutus samanlaisten molekyylien välillä on yhtä suuri kuin olemassa olevien molekyylien välillä.
Ionisen voiman käsitteen luominen auttoi poikkeamien selittämiseen ihanteellisesta käyttäytymisestä, havaittu todellisissa ionisissa ratkaisuissa.
[TOC]
Ionivoimayksiköt
Ionisella voimalla on yksiköinä moolia/l (molaarisuus) tai moolit/kg vettä (molealiteetti). Jälkimmäistä suositellaan ei -ideeaalisissa ratkaisuissa, jotka on tunnusomaista, koska niiden seosten määrät eivät ole täysin lisäaineita.
Tämä tarkoittaa esimerkiksi seuraavaa: jos sekoitettu 0.5 litraa nestettä A ja 0.5 litraa B -nestettä, tuloksena oleva tämän seoksen tilavuus, ei välttämättä ole yhtä litraa, mutta voi olla erilainen.
Ionista voimaa edustaa symboli I.
Voi palvella sinua: butanal: rakenne, ominaisuudet, käytöt ja riskitKuinka laskea ioninen voima?
Liuoksen ionisen voiman laskemiseksi otetaan huomioon kaikkien liuoksessa olevien ionien pitoisuus, samoin kuin niiden valenssit.
Ioninen voiman arvo saadaan soveltamalla seuraavaa kaavaa:
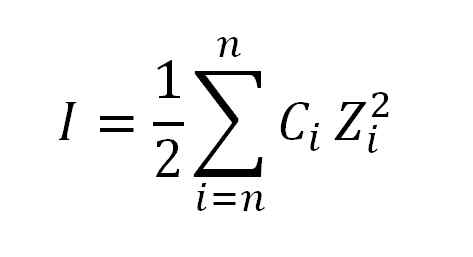 Kaava, jota käytetään ionisen voiman laskemiseen. Lähde: Gabriel Bolívar.
Kaava, jota käytetään ionisen voiman laskemiseen. Lähde: Gabriel Bolívar. Jos minä, kuten jo sanot, on ioninen voima; C, vastaa moraalista ionista tai moraalista ionipitoisuutta; Kun taas z edustaa niiden vastaavia valensseja (± 1, ± 2, ± 3, jne.-A.
Ionisen voiman (σ) laskelman kaavassa esiintyvä lauseke luetaan tiivistelmänä, ts. Kunkin liuoksessa olevan ionin molaaripitoisuuden (c) summa (z), sen valencia (z), C) korkea neliö.
Kuten voidaan nähdä, ionin valenssilla on suurin paino liuoksen ionisen voiman arvossa. Esimerkiksi: CA: n Valencia (Z) on +2, niin z2 Se on sama 4. Samaan aikaan Na ES +1: n Valencia (Z) ja siksi z2 Se on sama 1.
Tämä huomauttaa, että ionin CA: n panos2+ Ionisen voiman arvoon, samaan molaariseen ionipitoisuuteen, se on neljä kertaa suurempi kuin Na -ionin+.
Ionisen voiman merkitys
Ioninen voima on riittävä mitta liuoksen ionisen pitoisuuden ja on perusta Debye-Hückelin teorian määrittämiselle. Tämä teoria kuvaa ionisten ratkaisujen ihanteellista käyttäytymistä.
Ionivoima toimii perustana aktiivisuuskertoimen laskemiselle (γYllyttää), parametri, joka puolestaan mahdollistaa ionisen yhdisteen kemiallisen aktiivisuuden laskemisen, kemiallinen aktiivisuus on ionisen yhdisteen tehokas ja todellinen konsentraatio liuoksessa.
Voi palvella sinua: alumiiniasetaatti (Al (CH3COO) 3): rakenne, ominaisuudet, käyttötarkoituksetLisäämällä liuoksen ionista voimaa, ionien vuorovaikutus kasvaa. Siksi vähennä γYllyttää ja ionien kemiallinen aktiivisuus.
Ionin voiman lisääntyminen voi vähentää proteiinien liukoisuutta vesipitoisessa ympäristössä, tämä ominaisuus, jota käytetään proteiinin saostumiseen, on selektiivisesti. Plasmaproteiinien saostumiseen ja puhdistamiseen käytetään korkean määrän ionisia voima -sulfaatiliuoksia.
Esimerkkejä ionisista voimista
Esimerkki 1
Laske kaliumkloridiliuoksen (KCL) ionisvoima 0.3 m.
KCl hajoaa seuraavalla tavalla:
Kcl → k+ + Cl-
Meillä on kaksi ionia: Kation+ (Z =+1) ja Cl -anionin- (Z = -1). Käytämme sitten kaavaa ionisen voiman I laskemiseksi:
I = 1/2 [c · (+1)1 + C · (-1)1-
= 1/2 [0.3 m · 11 + 0 -.3 m · 11-
= 0.3 m
Huomaa, että Cl: n Valencia -1- Se otettiin 1, sen absoluuttinen arvo, koska muuten ioninen voima olisi yhtä suuri kuin 0.
Esimerkki 2
Laske kalsiumsulfaattiliuoksen ioninen voima (tapaus4) 0.5m
Tapaus4 Se hajoaa seuraavasti:
Kotelo4 → CA2+ + Sw42-
Meillä on kaksi ionia: kationi2+ (Z =+2) ja niin anioni42- (Z = -2). Käytämme sitten kaavaa ionisen voiman I laskemiseksi:
I = 1/2 [c · (+2)2 + C · (-2)2-
= 1/2 [0,5 m · 4 +0,5 m · 4]
= 2 m
Esimerkki 3
Laske iskunvaimentimen ioninen voima dibasisen natriumfosfaatin lopullisilla pitoisuuksilla (Na NA2HPO4) 0.3 m ja monobasinen natriumfosfaatti (NAH2Poikki4) 0.4 m.
Sitten eräs2HPO4 Se hajoaa seuraavasti:
Voi palvella sinua: arseenihappo (H3SO4): Ominaisuudet, riskit ja käytötNaa2HPO4 → 2+ + HPO42-
Kun taas Nah2Poikki4 Se hajoaa seuraavan kuvion jälkeen:
Ei2Poikki4 → NA+ + H2Poikki4-
Jatkamme edellisinä harjoituksina, tällä kertaa HPO -anionit42- (Z = -2) ja h2Poikki4- (Z = -1):
I = 1/2 [c · 2 · (+1)1 + C · (-2)2] +[C · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 2 · 1 +0.3 m · 4] +[0.4 m · 1 +0.4 m · 1]
= 1/2 [0.6 m +1.2 m] +[0.4 M +0.4 m]
= 1.3 m
Huomaa, että NA -pitoisuus+ NA: sta2HPO4 Se kerrotaan 2: lla, koska sen pitoisuus on kaksinkertainen. Kuitenkin toiselle suolalle, Nah2Poikki4, NA: n pitoisuus+ Kyllä, kerrotaan sen 1: llä sen liukenemisyhtälön stökiometrian mukaan.
Esimerkki 4
Laske natriumkloridiliuoksen (NaCl) ionisvoima 0.15 m ja glukoosi (C6H12JOMPIKUMPI6) 0.3 m.
NaCl dissosioituu seuraavasti:
NaCl → NA+ + Cl-
Glukoosi ei kuitenkaan ole dissosioitu ioneihin, koska sen kemiallisessa rakenteessa on vain kovalenttisia tyyppisiä sidoksia. Siksi Valencia de la glucosa (z) on yhtä suuri kuin nolla (0). Laskemme sitten NaCl: n ioninen voimatuote:
I = 1/2 [c · (+1)1 + C · (-1)1-
= 1/2 [0.15 m · 1 +0.15 m · 1]
= 0.15 m
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Wikipedia. (2020). Ionin lujuus. Haettu: vuonna.Wikipedia.Tai
- DR. David K. Ryan. (S.F.-A. Aktiviteetti- ja ionin lujuusluokka 4 Ryan. [PDF]. Haettu: Faculy.uml.Edu
- Michiganin yliopisto. (S.F.-A. Yksityiskohtaisempi katsaus kemialliseen tasapainoon. [PDF]. Toipunut: Umich.Edu
- Elsevier B.V. (2020). Ionin lujuus. Tiede. Haettu: ScienEdirect.com
- C.D -d. Kennedy. (1990). Ioninen stigngree ja happojen dinsocation. [PDF]. Toipunut: iubmb.Verkkokirjasto.Viiva.com
- « Kirjalliset tekstit ominaisuudet, tyypit ja esimerkit
- Isoprenorakenne, ominaisuudet, sovellukset »

