Heptano (C7H16) rakenne, ominaisuudet ja käyttötarkoitukset
- 4888
- 481
- Edgar VonRueden
Hän heptano Se on orgaaninen yhdiste, jonka kemiallinen kaava on c7H16 ja käsittää yhdeksän rakenteellista isomeeriä, joista tunnetuin on lineaarinen. Se on hiilivety, erityisesti alkaani tai parafiini, joka on useimmissa orgaanisissa kemian laboratorioissa, olipa opetus tai tutkimus.
Toisin kuin muut parafiiniset liuottimet, heptanolla on alhaisempi volatiliteetti, mikä hyödyntää sen suhteellisen turvallisempaa; Aina kun höyryjä ympäröi lämmönlähdettä ja se on toiminut uuttokellon sisällä. Jättäen syttyvyytensä syrjään, se on riittävän inertti yhdiste, joka toimisi orgaanisten reaktioiden keinona.
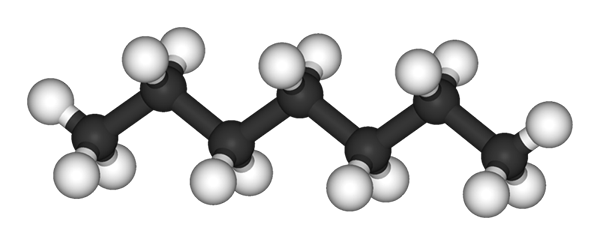
 N-heptano-molekyyli, jota edustaa malli palloista ja palkista. Lähde: Ben Mills ja Jynto [julkinen alue]
N-heptano-molekyyli, jota edustaa malli palloista ja palkista. Lähde: Ben Mills ja Jynto [julkinen alue] Yläkuvassa sinulla on rakenne n-Heptano, kaikkien heptaanien lineaarinen isomeeri. Koska se on yleisin isomeeri ja suurempi kaupallinen arvo, samoin kuin helpoin syntetisointi, on yleensä päättymässä, että termi 'heptano' tarkoittaa yksinomaan n-heptano; ellei toisin sanota.
Tämän nestemäisen yhdisteen pulloissa on kuitenkin määritelty, että se sisältää n-heptano. Niiden on paljastettava uuttokellon sisällä ja suoritettava mittaukset huolellisesti.
Se on erinomainen liuotin rasvoille ja öljyille, joten sitä käytetään usein kasvien olemusten tai muiden luonnontuotteiden aikana.
[TOC]
Rakenne
N-heptaani ja sen molekyylien väliset vuorovaikutukset
Kuten ensimmäisessä kuvassa voidaan nähdä, molekyyli n-Heptano on lineaarinen, ja hiiliatomien kemiallisen hybridisaation vuoksi ketju omaksuu sikzagueada -muodon. Tämä molekyyli on dynaaminen, koska sen C-C-sidokset voivat pyöriä, mikä saa ketjun taiton hieman eri kulmissa. Tämä myötävaikuttaa sen välisiin vuorovaikutuksiinsa.
Se voi palvella sinua: pi -linkkiHän n-Heptano on apolaarinen, hydrofobinen molekyyli, ja siksi sen vuorovaikutukset perustuvat Lontoon dispergoiviin voimiin; Nämä ovat ne, jotka riippuvat yhdisteen molekyylimassasta ja sen kosketusalueesta. Kaksi molekyyliä n-heptaani.
Nämä vuorovaikutukset ovat riittävän tehokkaita ylläpitämään molekyylejä n-heptano -yhtenäinen nesteessä, joka kiehuu 98 ºC: n lämpötilassa.
Isomeerit
 Heptaanin yhdeksän isomeeriä. Lähde: Steffen 962 [julkinen alue]
Heptaanin yhdeksän isomeeriä. Lähde: Steffen 962 [julkinen alue] Aluksi sanottiin, että kaava C7H16 edusti yhteensä yhdeksän rakenteellista isomeeriä, jotka olivat n-heptaani asiaankuuluvin (1). Yläkuvassa on esitetty muut kahdeksan isomeeriä. Huomaa paljaalla silmällä, että jotkut ovat haarautuneempia kuin toiset. Vasemmalta oikealle, ylhäältä alkaen, meillä on:
(2): 2-metyyliheksaan
(3): 3-metyyliheksaan, joka koostuu enantiomeerien parista (A ja B)
(4): 2,2-dimetyylipentano, joka tunnetaan myös nimellä Neoheptano
(5): 2,3-dimetyylipentano, jälleen enantiomeerien parilla
(6): 2,4-dimetyylipentano
(7): 3,3-dimetyylipentano
(8): 3-etyylipentaani
(9): 2,2,3-trimetyylibutaani.
Jokaisella näistä isomeereistä on riippumattomia ominaisuuksia ja sovelluksia n-Heptano, varattu enemmän kuin mitään orgaanisille synteesialueille.
Hepthane -ominaisuudet
Fyysinen ulkonäkö
Väritön neste, jonka haju on samanlainen kuin bensiini.
Moolimassa
100,205 g/mol
Sulamispiste
-90 549 ºC, tuleminen molekyylikiteeksi.
Kiehumispiste
98,38 ºC.
Höyrynpaine
52,60 atm 20 ºC: lla. Huomaa, kuinka korkea höyrynpaine on, vaikka ne ovat vähemmän haihtuvia kuin muut parafiiniset liuottimet, kuten heksaano ja pentani.
Tiheys
0,6795 g/cm3. Toisaalta heptano -höyryt ovat 3,45 kertaa tiheitä kuin ilma, mikä tarkoittaa, että heidän höyrynsä kestävät tiloissa.
Voi palvella sinua: muurahaishappo (HCOOH)Vesiliukoisuus
Hypofobisen yhdisteen heptaani voi tuskin liukenemista veteen aiheuttaen liuosta, jonka pitoisuus on 0,0003% lämpötilassa 20 ºC.
Liukoisuus muihin liuottimiin
Hepthane sekoittuu hiilitetrakloridin, etanolin, asetonin, öljyeetterin ja kloroformin kanssa.
Taitekerroin (nD -d-A
1 3855.
Goo
0,389 MPa · S
Lämpökapasiteetti
224,64 j/k · mol
sytytyspiste
-4 ºC
Itsensuuntainen lämpötila
223 ºC
Pintajännitys
19,66 mn/m 25 ºC
Palamislämpö
4817 kJ/mol.
Reaktiivisuus
Hepthane -höyryt, kun ne ovat lähellä lämmönlähdettä (liekki), reagoivat eksoterisesti ja voimakkaasti ilman hapen kanssa:
C7H16 + 11o2 => 7Co2 + 8h2JOMPIKUMPI
Palamisreaktion ulkopuolella heptaani on kuitenkin melko vakaa neste. Sen reaktiivisuuden puute johtuu siitä, että niiden C-H-linkkejä on vaikea rikkoa, joten se ei ole alttiita substituutioille. Se ei myöskään ole kovin herkkä vahvoille hapettaville aineille, mikäli lähellä ei ole tulipaloa.
Heptanon suurinta vaaraa edustaa sen suuri volatiliteetti ja syttyvyys, joten palohiski on, jos se vuotaa kuumia kohteita.
Sovellukset
Liuotin ja puoli reaktiota
 Hepthane on erinomainen liuotin öljyjen ja rasvojen liuottamiseksi. Lähde: Pxhere.
Hepthane on erinomainen liuotin öljyjen ja rasvojen liuottamiseksi. Lähde: Pxhere. Heptanon hydrofobinen luonne on erinomainen liuotin öljyjen ja rasvojen liuottamiseksi. Tässä näkökulmassa sitä on käytetty rasvanpoistoaineena. Sen suurin sovellus on kuitenkin käytettynä uuttoliuottimena, koska se liukenee lipidikomponentit sekä näytteen muut orgaaniset yhdisteet.
Esimerkiksi, jos haluat erottaa kaikki jauhettua kahvin komponentteja, se olisi makeria heptaanissa veden sijasta. Tämä menetelmä ja sen variaatiot on toteutettu kaikentyyppisillä siemenillä, mitkä kasvien olemukset ja muut luonnontuotteet on saatu.
Se voi palvella sinua: yhtenäinen solu: Ominaisuudet, punaiset vakiot ja tyypitHeptaani, joka on luonnollisesti väritön, värjätään uutetun öljyn väristä. Sitten tätä pyöritetään, jotta öljyä on lopulta mahdollisimman puhdasta.
Toisaalta heptaanin pieni reaktiivisuus antaa sinun myös olla vaihtoehto, kun harkitset reaktiovälineitä synteesin suorittamiseksi. Koska se on hyvä orgaanisten yhdisteiden liuotin, se takaa, että reagenssit pysyvät liuoksessa ja ovat vuorovaikutuksessa toistensa kanssa, kun ne reagoivat.
Saostumisaine
Öljykemiassa on yleinen käytäntö saostaa raa'an näytteen asfaltensia lisäämällä heptano. Tämä menetelmä mahdollistaa erilaisten raaka -aineiden stabiilisuuden tutkimisen ja määrittämisen, kuinka herkkä sen asfalteenipitoisuus on saostaa ja kantaa koko sarjan ongelmia öljyteollisuudelle.
Oktaani
Heptaania on käytetty polttoaineena suuren määrän lämpöä, jota se tarjoaa, kun se palaa. Automoottorien suhteen se olisi kuitenkin haitallista sen toimintaan, jos sitä käytetään puhtaasti. Koska se palaa erittäin räjähtävästi, se määrittelee 0: n bensiinin oktaanialueella.
Bensiini sisältää suuren prosenttiosuuden heptanosta ja muista hiilivetyistä taseen oktaaniarvoihin tunnetuiksi arvoiksi (91, 95, 87, 89 jne.-A.
Viitteet
- Morrison, r. T. ja Boyd, R, N. (1987). Orgaaninen kemia. 5. painos. Toimituksellinen Addison-Wesley Inter-American.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. (10. painos.-A. Wiley Plus.
- Wikipedia. (2020). Heptaani. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2020). Heptani -pubchem -tietokanta. CID = 8900. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Elsevier B.V. (2020). Heptaani. Tiede. Haettu: ScienEdirect.com
- Bell Chem Corp. (7. syyskuuta 2018). Heptaanin teollisuuskäyttö. Toipunut: Bellchem.com
- Andrea Kropp. (2020). Heptaani: rakenne, käyttö ja kaava. Opiskelu. Toipunut: Opiskelu.com
- « Tiivistetty kaava Mikä on ja esimerkkejä (metaani, etaani, glukoosi ...)
- Mekaaniset energiakaavat, konsepti, tyypit, esimerkit, harjoitukset »

