Elohopeahydroksidirakenne, ominaisuudet, käytöt, riskit
- 1395
- 35
- Joshua Emmerich
Hän Elohopeahydroksidi Se on epäorgaaninen yhdiste, jossa elohopeametalli (HG) on hapettumisnumero 2+. Sen kemiallinen kaava on Hg (OH)2. Tätä lajia ei kuitenkaan ole vielä saatu kiinteässä muodossa normaaleissa olosuhteissa.
Elohopea- tai elohopeahydroksidihydroksidi on siirtymävaiheessa lyhyt elämän välittäjä HGO -elohopeaoksidin muodostumisessa alkalisessa liuoksessa. HGO -elohopeaoksidiliuoksissa suoritetuissa tutkimuksissa on päätelty, että HG (OH)2 Se on heikko pohja. Muut sen mukana olevat lajit ovat hgoh+ ja Hg2+.
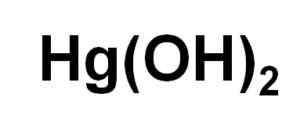 Elohopeahydroksidin kemiallinen kaava (II). Kirjoittaja: Marilú Stea.
Elohopeahydroksidin kemiallinen kaava (II). Kirjoittaja: Marilú Stea. Huolimatta siitä, ettei sitä voida saostua vesiliuoksessa, Hg (OH)2 Se on saatu elohopean fotokemiallisella reaktiolla vedyn ja hapen kanssa erittäin alhaisissa lämpötiloissa. Se on myös saatu kopion muodossa yhdessä uskon kanssa (OH)3, missä haluro -ionien läsnäolo vaikuttaa pH: hon, jossa kopiointi tapahtuu.
Koska se ei ole helposti saatu puhdasta laboratoriotasolla, tälle yhdisteelle ei ole ollut mahdollista löytää mitään hyödyllisyyttä tai määrittää sen käytön riskit. Voidaan kuitenkin päätellä, että sillä on samat riskit kuin muilla elohopeayhdisteillä.
[TOC]
Molekyylirakenne
Elohopeahydroksidin (II) Hg (OH) rakenne (OH)2 Se perustuu elohopeaatomin muodostamaan lineaariseen keskusosaan kahdella happiatomilla sivuille.
Vetyatomit yhdistetään tähän keskusrakenteeseen, jokainen jokaisen hapen vieressä, jotka kääntyvät vapaasti kunkin hapen ympärille. Se voitaisiin edustaa yksinkertaisella tavalla, kuten alla on osoitettu:
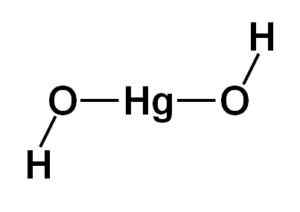 Elohopeahydroksidin teoreettinen rakenne (II). Kirjoittaja: Marilú Stea
Elohopeahydroksidin teoreettinen rakenne (II). Kirjoittaja: Marilú Stea Elektroninen kokoonpano
Metallisen elohopea Hg: n elektroninen rakenne on seuraava:
[Xe] 5d -d10 6s2
missä [xe] on jalokaasun ksenonin elektroninen kokoonpano.
Tätä elektronista rakennetta tarkkailemalla on johdettu, että elohopean vakain hapettumistila on se, jossa kerroksen 6 2 elektronia menetetääns.
Hg (OH) -hydroksidissa2, Elohopeaatomi (HG) löytyy sen hapetustilasta 2+. Siksi Hg (OH)2 Elohopealla on seuraava sähköinen kokoonpano:
Se voi palvella sinua: 30 karboksyylihappojen käyttöä arjessa[Xe] 5d -d10
Nimikkeistö
- Elohopeahydroksidi (II)
- Elohopea hydroksidi
- Elohopea dihydroksidi
Ominaisuudet
Molekyylipaino
236,62 g/mol
Kemialliset ominaisuudet
Kuultujen tietojen mukaan on mahdollista, että HG (OH)2 Olla väliaikainen yhdiste HGO: n muodostumisessa emäksisessä vesipitoisessa väliaineessa.
Hydroksyyli -ionien lisääminen (OH-) vesiliuokseen elohopea -ionilla Hg2+ Se johtaa keltaisen kiinteän elohopeaoksidin (II) HGO: n saostumiseen, josta Hg (OH)2 Se on matkustaja tai väliaikainen agentti.
 Elohopeaoksidi (II). Leiem [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikipedia Commons.
Elohopeaoksidi (II). Leiem [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikipedia Commons. Vesiliuoksessa Hg (OH)2 Se on hyvin lyhyt elämän välittäjä, koska se vapauttaa nopeasti vesimolekyylin ja saostaa kiinteän HGO: n.
Vaikka elohopea hydroksidi Hg (OH) ei ole ollut mahdollista saostaa2, Elohopeaoksidi (II) HGO on jotain liukenevaa vettä muodostaen lajien liuoksen, jota kutsutaan "hydroksideiksi".
Nämä vettä, jota kutsutaan "hydroksidiksi", ovat heikkoja emäksiä ja vaikka joskus ne käyttäytyvät kuin amfotoraatteja, yleensä Hg (OH)2 Se on emäksisempi kuin happo.
Kun HGO liukenee HCLO: hon4 Tutkimukset osoittavat elohopea -ionin hg: n esiintymisen2+, HGOH -monohydroximercuro -ioni+ ja Hg (OH) Mercuric Hydroksidi2.
Tällaisissa vesiliuoksissa esiintyvät saldot ovat seuraavat:
Hg2+ + H2Tai ⇔ hgoh+ + H+
Hoho+ + H2Tai ⇔ Hg (OH)2 + H+
NaOH: n alkalisissa liuoksissa laji Hg (OH) muodostuu3-.
Saada
Puhdas elohopeahydroksidi
Elohopeahydroksidi (ii) Hg (OH)2 Sitä ei voida saada vesiliuoksesta, koska lisäämällä alkalia Hg -kauppiaiden ionien liuokseen2+, saosta keltainen elohopea oksidi.
Jotkut tutkijat onnistuivat kuitenkin hankkimaan vuonna 2005 ensimmäistä kertaa HG (OH) -hydroksidi2 Käyttämällä elohopeakaarilamppua elohopea -Hg -elementin, vety H2 ja happi tai2.
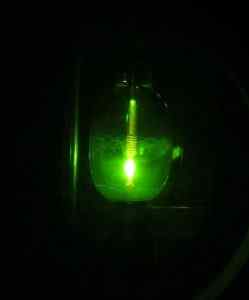 Elohopeavalaisin. D-Kuru [CC BY-SA 2.0 at (https: // creativecommons.Org/lisenssit/by-SA/2.0/at/teko.sisään)]. Lähde: Wikipedia Commons.
Elohopeavalaisin. D-Kuru [CC BY-SA 2.0 at (https: // creativecommons.Org/lisenssit/by-SA/2.0/at/teko.sisään)]. Lähde: Wikipedia Commons. Reaktio on fotokemiallinen ja suoritettiin neonin, argonin tai kiinteän deuteriumin läsnä ollessa erittäin alhaisissa lämpötiloissa (noin 5 K = 5 astetta Kelvin). Yhdisteen muodostumisen todisteet saatiin IR -valon imeytymispektrillä (infrapuna).
Voi palvella sinua: SadateHg (OH)2 Tällä tavalla valmistettu on erittäin vakaa kokemuksen olosuhteissa. On arvioitu, että fotokemiallinen reaktio etenee O-HG-O-välittäjän kautta stabiiliin molekyyliin H-O-HG-O-H.
Solamenki rautahydroksidilla (III)
Jos elohopeasulfaatti (ii) HGSO liukenee4 ja rautasulfaatti (iii) usko2(SW4-A3 Happamassa vesipitoisessa liuoksessa ja pH alkaa lisätä lisäämällä NaOH -natriumhydroksidiliuosta, päätetyn kiinteän aineen jälkeen muodostettua kiinteää ainetta on Computed Hg (OH) (OH)2 ja usko (Voi)3.
On havaittu, että Hg: n (OH) muodostuminen2 Se on kriittinen vaihe tässä yhteisymmärryksessä uskon kanssa (OH)3.
Hg (OH) muodostuminen2 Saostumassa uskossa (OH)3-HG (OH)2 Se riippuu voimakkaasti ionien, kuten fluoridin, kloridin tai bromidin, läsnäolosta näiden spesifisen pitoisuuden ja liuoksen pH: n suhteen.
Fluoridin läsnä ollessa (F-), PH, joka on yli 5, Hg (OH) -sopimus, Hg (OH)2 Uskossa (OH)3 ei vaikuta. Mutta pH: lle 4: n kompleksien muodostuminen Hg: n välillä2+ ja f- häiritsee Hg: n (OH) kopiointia2.
Kloridin esiintyessä (CL-), Hg: n (OH) kumppanuus2 Se tapahtuu pH: lle, joka on vähintään 7, ts. Edullisesti alkalisessa väliaineessa.
Kun bromidi on läsnä (BR-), Hg: n (OH) kumppanuus2 Se näyttää vielä suuremmasta pH: sta, ts. PH: n yli 8,5 tai alkalisemmalta kuin kloridilla.
Sovellukset
Käytettävissä olevien tietolähteiden tarkistamisesta seuraa, että elohopeahydroksidi (ii) Hg (OH)2, Koska se ei ole vielä valmistettu kaupallisesti, sillä ei ole tunnettuja käyttötarkoituksia.
Viimeisimmät tutkimukset
Tutkittiin laskennallisten simulaatiotekniikoiden avulla vuonna 2013 rakenne- ja energiaominaisuuksia, jotka liittyvät Hg (OH) -nesteeseen2 Kaasumaisessa tilassa.
Metalli-ligandon koordinaatio- ja liuottimien energiat laskettiin ja verrattiin muuttamalla Hg (OH) -teoksen astetta2.
Muun muassa havaittiin, että ilmeisesti teoreettinen hapettumistila on 1+ väitetyn 2+: n sijasta, joka yleensä on osoitettu Hg (OH)2.
Voi palvella sinua: teoreettinen suorituskykyRiskejä
Vaikka Hg (OH)2 Sellaisena ei ole eristetty riittävästi.
Se voi olla myrkyllistä hermostolle, ruuansulatukselle, iholle, silmille, hengityselimille ja munuaisille.
Elohopeayhdisteiden ihon hengitys, nauttiminen tai kosketus voi aiheuttaa vaurioita silmien ja ihon ärsytyksestä, unettomuudesta, päänsärkyistä, vapinaa, suoliston vaurioita, muistin menetystä, munuaisten vajaatoimintaan, muiden oireiden välillä.
Elohopea on tunnustettu kansainvälisesti epäpuhtaukseksi. Suurin osa ympäristöön ja sedimenteissä olevat bakteerit, jotka joutuvat ympäristön kanssa kosketukseen, metyloivat metyylielohopeaa.
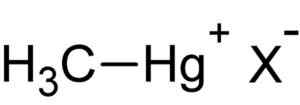 Metyylielohopea HAL. Kirjoittaja: Lähettäjä käyttäjä: Rifleman 82. Lähde: Tuntematon. Lähde: Wikipedia Commons.
Metyylielohopea HAL. Kirjoittaja: Lähettäjä käyttäjä: Rifleman 82. Lähde: Tuntematon. Lähde: Wikipedia Commons. Tämä yhdiste on bioakcumula elävissä organismeissa, jotka kulkevat maasta kasveihin ja sieltä eläimille. Vesiympäristössä siirto on vielä nopeampi, kulkemalla hyvin pienistä lajeista suuriin lyhyessä ajassa.
Metyylielohjauksella on myrkyllinen vaikutus eläviin olentoihin ja erityisesti ihmiseen, mikä nauttii sitä ruokaketjun kautta.
Ruoan nauttimisen yhteydessä on erityisen haitallista pienille lapsille ja sikiöille raskaana olevilla naisilla, koska neurotoksiinina oleminen voi aiheuttaa aivovaurioita ja hermostoa muodostumisessa ja kasvussa.
Viitteet
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Wang, Xuefeng ja Andrews, Lester (2005). Hg (OH) -infrapunaspektri2 kiinteässä neonissa ja argonissa. Epäorgaaninen kemia, 2005, 44, 108-113. Pubista toipunut.ACS.org.
- Amaro-esrada, J.Yllyttää., et al. (2013). Hg (OH) vesipitoinen solvaatio2: Energinen ja dynaamisen tiheyden funktionaalinen teoriatutkimukset Hg: stä (OH)2-(H2JOMPIKUMPI)n (N = 1-24) rakenteet. J -. Fyysinen. Kemia. Vuoteen 2013, 117, 9069-9075. Pubista toipunut.ACS.org.
- Inoue, Yoshikazu ja Munemori, Makoto. (1979). Elohopean (ii) raudan (III) hydroksidin kopiointi (II). Ympäristötiede ja tekniikka. Osa 13, numero 4, huhtikuu 1979. Pubista toipunut.ACS.org.
- Chang, L.W -., et al. (2010). Hermosto ja käyttäytymistoksikologia. Toksikologian ymmärtämisessä. ScienEdirect.com.
- Haney, Alan ja Lipsey, Richard L. (1973). Metyyli -elohopeahydroksidin kertyminen ja vaikutukset maanpäällisessä ruokaketjussa laboratorioiden asuntojen alla. Ympäristö. Saastuttaa. (5) (1973) PP. 305-316. ScienEdirect.com.
- « Flavin -adeniini -dinukleotidi (FAD) -ominaisuudet, biosynteesi
- Glyseraldehydi 3-fosfaatti (G3P) -rakenne, toiminnot »

