Aineen ruumiillinen malli
- 3396
- 416
- Ronald Reilly
 Asiat tunnetuimpien tilojen selitys on asian runsaasti
Asiat tunnetuimpien tilojen selitys on asian runsaasti Mikä on aineen korpuskulaarinen malli?
Hän Aineen ruumiillinen malli Se on malli aineen mikroskooppisesta rakenteesta, jolla pyritään selittämään ominaisuudet ja käyttäytymisen kussakin aggregaation tilassa.
Mallin perustavanlaatuinen postulaatti on, että aine koostuu pienistä hiukkasista, jotka voivat olla atomeja, ioneja tai molekyylejä, aina jatkuvassa levottomuudessa.
Tässä mallissa klassisen mekaniikan lakeja hiukkasille sovelletaan, vaikka suurella lukumäärällä niitä ei tutkita erikseen, vaan tilastollisen käsittelyn kautta. Tällä tavoin saadaan mielenkiintoisten makroskooppisten suuruuksien, kuten paine, lämpötila ja tilavuus, keskiarvot.
Corpuscular -malli selittää myös ominaisuudet, kuten viskositeetti, kovuus, joustavuus ja materiaalien tiheys sekä lämmönlaajuus, muun muassa ilmiöt.
Aineen kouriskulaarisen mallin alkuperä
Ideat aineen ruumiin luonteesta ovat vähintään 5. vuosisadalla.C. Muinaisessa Kreikassa, Leucipossa (450 a. C. - 370 a. C.) ja demokraatti (460 - 370 - C), sen opetuslapsi, olivat spekuloineet aineen järjestämisestä mikroskooppisella tasolla.
Nämä filosofit ehdottivat, että aine koostuu pienistä jakamattomista hiukkasista, jotka on nimitetty atomit, Kreikkalaisen juuren sana, joka tarkoittaa tarkasti "jakamista".
Teorian sulki Aristoteles, aikansa vaikutusvaltaisin salvia. Kuitenkin vasta seitsemännentoista vuosisadan aikana korpuskulaarinen teoria alkoi jälleen olla merkityksellistä, ja 1800 -luvulla aineen salaisuudet alkoivat lopulta paljastaa.
Vuonna 1803 englantilainen kemisti John Dalton (1766-1844) ehdotti jälleen, että asia muodostettiin atomeiksi kutsuttujen selkinnien avulla, jotka yhdistettiin tietyissä mittasuhteissa aineen molekyylien muodostamiseksi.
Daltonin atomit olivat jakamattomia, mutta pian kehitettiin vankka teoreettinen rakenne, etenkin James C: n ansiosta. Maxwell (1831-1979) ja Ludwig Boltzmann (1844-1906). Tämä perusti tilastollisen mekaniikan ja kiinteän tilan fysiikan perustan.
Se voi palvella sinua: keskimääräinen nopeus: kaavat, miten se lasketaan ja ratkaistaanAineen korpuskulaarisen mallin perusteet
Mallin tärkeimmät postulaatit ovat:
- Aine, riippumatta niiden aggregaation tilasta, muodostuu mikroskooppisilla hiukkasilla, jotka voivat olla yksittäisiä tai yhdistelmäatomeja, muodostaakseen molekyylit.
- Eri aineet eroavat toisistaan, koska ne muodostavat eri hiukkaset.
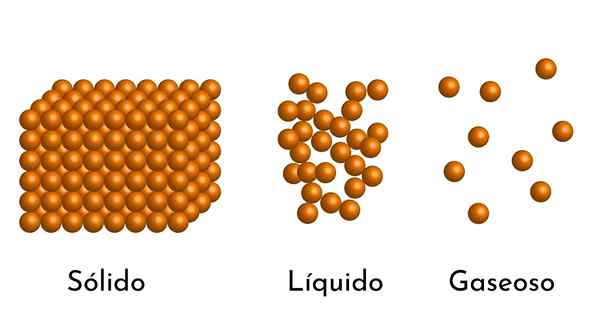
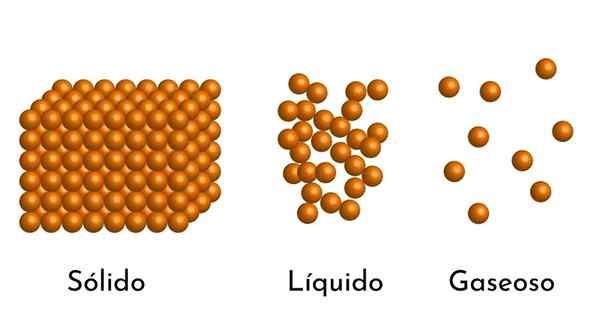
- Aineen aggregaatiotilan mukaan hiukkasten välillä on tyhjiä tiloja, kaasuissa suurempia ja pienempiä kiinteitä aineita.
- Asiaa muodostavat hiukkaset ovat ikuisessa levottomuudessa. Suurempaan levottomuuteen, suurempaan kineettiseen energiaan, ja jos lämpöä lisätään, hiukkasten liikkuminen lisääntyy.
- Myös nesteissä ja kiinteissä aineissa hiukkaset kokevat erilaisen voimakkuuden vetovoiman molekyylien välisistä voimista. Kaasuissa molekyylit ovat hyvin erillisiä ja liikkuvat nopeasti, joten näillä voimilla ei ole suurempaa esiintyvyyttä. Mutta nesteissä, joiden hiukkasilla on enemmän koheesiota, nämä voimat ovat voimakkaampia, ja kiinteissä aineissa se on vielä suurempi.
Kaasujen kineettinen teoria
Corpuscular -malli käytettiin ensin kaasuihin, koska se on yksinkertaisin aggregaatiotila ja molekyylien välinen koheesiovoimat ovat minimaalisia. Lisäksi kaasujen ominaisuudet tunnetaan hyvin englantilaisen kemistin Robert Boylen ja ranskalaisen Joseph Gay Lussacin ja Jacques Charlesin kokeellisten teosten kautta.
Ihanteellinen kaasumalli, yksinkertaisin, harkitsee sitä:
- Hiukkasten koko on paljon pienempi kuin niiden väliset etäisyydet ja että säiliön mitat. Ne ovat erityisiä massoja, ts.
- Hiukkaset ovat pysyvässä levottomuudessa, koska ne ovat vain käännöksen liikettä.
- Toisinaan hiukkaset törmäävät toisiinsa, toistensa kanssa ja säiliön seinien kanssa. Täysin joustavissa iskuissa kineettinen energia säilyy.
- Molekyylien välillä ei ole houkuttelevia voimia. Ainoa vuorovaikutus johtuu ajoittain tapahtuvista törmäyksistä ja hyvin lyhyeksi ajaksi. Muista molekyylistä toimii muista riippumatta.
- Jos hiukkasjärjestelmään ei ole ulkoisia voimia, ne jakautuvat tasaisesti koko käytettävissä olevaan tilavuuteen.
Vaikka tämä on yksinkertaisin malli, selittää minkä tahansa tiheän kaasun käyttäytymisen korkeissa lämpötiloissa ja alhaisissa paineissa. Tutkijat ovat kehittäneet muita paremmin sopeutuneita malleja todellisten kaasujen käyttäytymiseen, jotta he pitävät sitä:
- Molekyyleillä on mitattavissa oleva koko.
- Molekyylien välisiä voimia ei peruuteta.
Ihanteellinen kaasuyhtälö
Ihanteellisen kaasun postulaattien ansiosta ilmenee lauseke, joka liittyy paineen p, tilavuuden V ja lämpötilan t makroskooppiset suuruudet:
P ∙ v = nrt
Missä n on kaasun ja r -moolien lukumäärä on kaasujen yleinen vakio, jonka arvo kansainvälisissä järjestelmäyksiköissä on 8.314 J/mol ∙ K.
Kineettinen energia ja lämpötila
Ihanteellisessa kaasussa kaikki sisäiset energiat ilmenevät kineettisenä energiana. Ihanteellisen kaasun N -molekyylien keskimääräinen kineettinen energia on suoraan verrannollinen sen lämpötilaan Kelvinissä:
Nesteiden ja kiintoaineiden korisuskulaarimalli
Itse asiassa kaikki aine löytyy kolmesta yksinkertaisimmasta tilasta: kuten kaasu, neste tai kiinteä, paineesta ja lämpötilasta riippuen. On muitakin aggregaatiotiloja, kuten plasma, mutta ei lähellä maan pintaa.
Nämä tilat johtuvat tavasta, jolla molekyylien välinen vetovoimat toimivat, jotka ovat lyhytaikaisia, ts. Ne eivät toimi, jos molekyylien välinen etäisyys on erittäin suuri ja hiukkaset liikkuvat suurella nopeudella. Näin on kaasut, mikä mahdollistaa levitys nopeampi. Tämä selittää, että tuoksun paljastamalla aromi leviää nopeasti.
Voi palvella sinua: mikä on magneettinen hetki?Toisaalta, kun hiukkaset ovat lähempänä ja niiden liike on hitaampi, kuten nesteissä ja kiinteissä aineissa, näillä molekyylien välisillä voimilla on mahdollisuus suorittaa toiminta.
Siten, kun kaasu kulkee nestemäiseen tilaan, sen tilavuus pienenee, koska sen hiukkasten välinen etäisyys vähenee ja vielä enemmän, kun se tulee kiinteäksi.
Aine nestemäisessä tilassa
Nestemäisessä tilassa molekyylien väliset voimat eivät ole halveksittavia, vaan toimivat pienemmässä mittakaavassa kuin kiinteässä tilassa. Hiukkaset muodostavat pieniä ryhmiä, jotka hajoavat ja ryhmittelevät jatkuvasti uudelleen, tarjoamalla liikkuvuuden materiaalille, vaikkakin kiinteän tilavuuden ylläpitäminen.
Tämä liikkuvuus antaa nesteet sopeutua säiliön muotoon ja antaa heille kyvyn virtaus. Diffuusio voi tapahtua, mutta hitaammin kuin kaasuissa.
Silti hiukkasilla on tarpeeksi koheesio siten, että neste pysyy puristamattomana laajalla lämpötila -alueella.
Pintajännitys
Nesteen pinnalla on molekyylejä, joilla epätasapainoiset molekyylien väliset voimat toimivat, aiheuttaen nettovoiman ylös. Tämä nettovoima on minimoitu, kun nesteellä on alhaisin mahdollinen pinta.
Tämän voiman ansiosta nastat, leikkeet, hyönteiset ja muut pienet esineet onnistuvat pysymään veden edelleen pinnalla uppoutumatta.
 Tässä kuvassa molekyyli näkyy nesteen pinnalla, jolla nettovoima vaikuttaa, mikä antaa hyönteisen kävellä vedellä uppoutumatta
Tässä kuvassa molekyyli näkyy nesteen pinnalla, jolla nettovoima vaikuttaa, mikä antaa hyönteisen kävellä vedellä uppoutumatta Solid -state -aine
Kiinteässä tilassa hiukkaset ovat hyvin lähellä toisiaan, ja molekyylien väliset voimat saavat hiukkaset pysymään kiinteissä asennoissa. Vaikka kiinteät aineet voivat väristyä tämän asennon ympärillä, ne omaksuvat määritellyn muodon ja ylläpitävät vakion tilavuutensa.
Kun lämpö virtaa, värähtelyliikkeen amplitudi kasvaa ja lämpötila nousee. Tämä aiheuttaa kehon mitat nousevan lämpötilan myötä, ilmiöksi kutsuttu Lämmön laajentuminen. Jos lämpövirtaa tarpeeksi, kiinteä aine voi jopa mennä nestefaasiin.


