Atomin kvantmekaaninen malli

- 3538
- 29
- Kelly Kilback
Mikä on atomin kvantmekaaninen malli?
Hän Atomin kvantmekaaninen malli Oletetaan, että tämän muodostuu protonien ja neutronien muodostama keskeinen ydin. Negatiivisen kuormituksen elektronit käärivät ytimen diffuusi -alueisiin, jotka tunnetaan orbitaaleina.
Elektronisten orbitaalien muoto ja pidennys määritetään useilla suuruuksilla: elektronien ydinpotentiaali ja kvantitoituvat tasot ja kulmavirta.
 Kuvio 1. Helium -atomin malli kvanttimekaniikan mukaan. Se koostuu kahden tuhannen kertaa pienempien positiivisen ytimen ympäröivän kahden heliumelektronin todennäköisyyspilvistä. Lähde: Wikimedia Commons.
Kuvio 1. Helium -atomin malli kvanttimekaniikan mukaan. Se koostuu kahden tuhannen kertaa pienempien positiivisen ytimen ympäröivän kahden heliumelektronin todennäköisyyspilvistä. Lähde: Wikimedia Commons. Kvanttimekaniikan mukaan elektronit ovat kaksoisaalto-hiukkasten käyttäytyminen ja atomiasteikko ovat diffuusi ja epäspesifinen. Atomin mitat määritetään käytännössä positiivisen ytimen ympäröivien elektronisten orbitaalien laajentamisella.
Kuvio 1 esittää heliumiatomin rakennetta, jolla on ydin, jossa on kaksi protonia ja kaksi neutronia. Tätä ydintä ympäröi kahden ytimen ympäröivän elektronin todennäköisyyspilvi, joka on satatuhatta kertaa pienempi. Seuraavassa kuvassa voit nähdä helium -atomin, ytimen ja elektronien protonit ja neutronit.

Helium -atomin koko on luokkaa a angstrom (1 Å), eli 1 x 10^-10 m. Kun taas sen ytimen koko on luokkaa a femtometri (1 fm), eli 1 x 10^-15 m.
Huolimatta niin pienestä suhteellisesta, 99,9% atomipainosta on keskittynyt pieneen ytimeen. Tämä johtuu siitä, että protonit ja neutronit ovat 2000 kertaa raskaampia kuin niitä ympäröivät elektronit.
Voi palvella sinua: 31 fysiikan voimantyyppiä ja niiden ominaisuuksiaAtomi -asteikko ja kvanttikäyttäytyminen
Yksi käsitteistä, joilla oli eniten vaikutusta atomimallin kehitykseen, oli kaksinaisuus Aalto - hiukkas: Löytö, että jokaisella materiaaliobjektilla on aineen aalto.
Kaava, joka sallii aallonpituuden laskemisen λ Louis de Broglie ehdotti aineelliseen esineeseen vuonna 1924, ja se on seuraava:
λ = h / (m v)
Missä h Se on Planckin vakio, m taikina ja v nopeus.
De Broglien periaatteen mukaan jokaisella esineellä on kaksoiskäyttäytyminen, mutta vuorovaikutusten, nopeuden ja massan asteikosta riippuen aaltokäyttäytyminen voi olla entistä enemmän kuin hiukkaset tai päinvastoin.
Elektroni on kevyt, sen massa on 9,1 × 10^-31 kg. Elektronin tyypillinen nopeus on 6000 km/s (viisikymmentä kertaa pienempi kuin valon nopeus). Tämä nopeus vastaa energia-arvoja kymmenien elektroni-voltio-alueella.
Edellisten tietojen ja käyttämällä de Broglie -kaavaa voidaan saada elektronin aallonpituus:
λ = 6,6 x 10^-34 J S / (9,1 × 10^-31 kg 6 x 10^6 m / s) = 1 x 10^-10 m = 1 Å
Elektronilla atomitasojen tyypillisiin energioihin on saman suuruusluokan aallonpituus kuin atomi -asteikolla, niin että siinä asteikolla sillä on lainakeskuksessa olevaa eikä hiukkasten käyttäytymistä.
Ensimmäiset kvanttimallit
Kehitettiin ajatuksen ajatellen, että atomi -asteikon elektronilla on aaltoileva käyttäytyminen, kehitettiin ensimmäiset kvanttiperiaatteisiin perustuvat atomimallit. Näistä Bohrin atomimalli erottuu, mikä ennusti täydellisesti vetyemissiospektrin, mutta ei muiden atomien,.
Voi palvella sinua: Jännitystyö: Kaava ja yhtälöt, laskenta, harjoituksetBohrin malli ja myöhemmin Sommerfeldin malli olivat puoliklassisia malleja. Toisin sanoen elektroni oli hiukkasena, jota altistettiin sen ympärillä kiertävän ytimen sähköstaattiselle vetovoimalle, Newtonin toinen laki hallitsee.
Klassisten kiertoratojen lisäksi nämä ensimmäiset mallit ottivat huomioon, että elektronilla oli siihen liittyvä materiaaliaalto. Vain kiertoradat, joiden kehä oli aallonpituuksien kokonaisluku, sallittiin, koska ne, jotka eivät täytä tätä kriteeriä.
Silloin energian kvantisointi atomirakenteessa ilmestyy ensimmäistä kertaa.
Sana kvantti Tarkalleen johtuu siitä, että elektroni voi ottaa vain joitain erillisiä energia -arvoja atomin sisällä. Tämä tapahtuu samanaikaisesti Planckin havainnon kanssa, joka koostui havainnosta, että taajuussäteily F Vuorovaikutuksessa aineen kanssa energiapaketeissa E = h f, missä h Se on Planckin vakio.
Kiertoradan muoto ja koko
Kiertoradan säteittäinen laajuus määritetään radi -aaltofunktiosiihen. On suurempi siinä määrin, että elektronin energia kasvaa, toisin sanoen siinä määrin kuin pääkvanttimäärä kasvaa.
Radiaalinen etäisyys mitataan yleensä BOHR-radioissa, mikä on pienimmän vetyenergian kannalta 5,3 x 10-11 m = 0,53 Å.
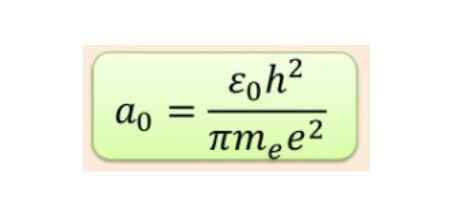 Kuva 2. Bohr -säde kaava. Lähde: f. Zapata.
Kuva 2. Bohr -säde kaava. Lähde: f. Zapata. Mutta kiertoratojen muoto määritetään kulman momentin kvanttimäärän arvon perusteella. Jos l = 0, sinulla on pallomainen kiertorata, jos l = 1 sinulla on lohko -kiertorata, jota kutsutaan p, joilla voi olla kolme suuntausta magneettisen kvanttiluvun mukaan. Seuraava kuva näyttää orbitaalien muodon.
Voi palvella sinua: vektorisuuntaus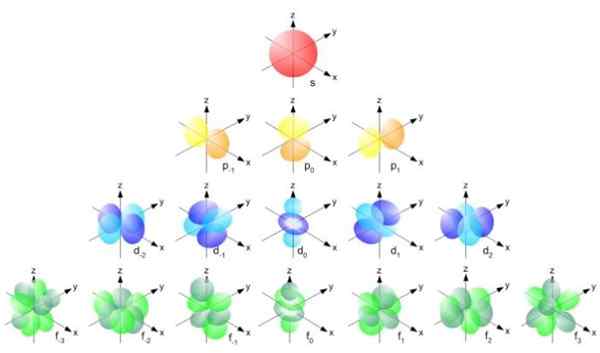 Kuva 3. Orbitaalien muoto S, P, D, F. Lähde: Ucdavis Chemwiki.
Kuva 3. Orbitaalien muoto S, P, D, F. Lähde: Ucdavis Chemwiki. Nämä orbitaalit on pakattu muihin elektronien energian mukaan. Esimerkiksi seuraava kuva näyttää orbitaalit natriumiatomisessa.
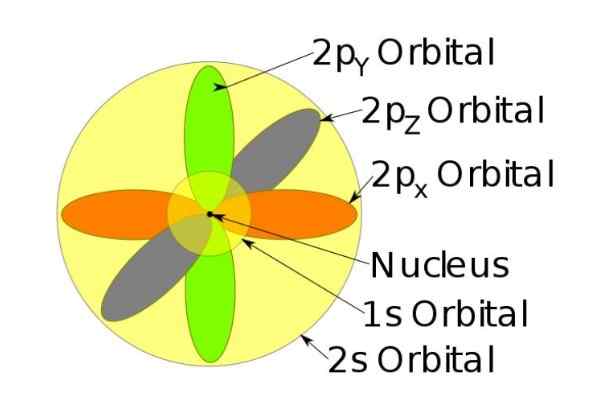 Kuva 4. Orbitaalit 1S, 2S, 2p natriumionilla, kun se on menettänyt elektronin. Lähde: Wikimedia Commons.
Kuva 4. Orbitaalit 1S, 2S, 2p natriumionilla, kun se on menettänyt elektronin. Lähde: Wikimedia Commons. Spin
Schrödinger -yhtälön kvantmekaaninen malli ei sisällä elektronien spiniä. Mutta Pauli otetaan huomioon poissulkemisperiaatteen kautta, mikä osoittaa, että orbitaalit voivat täyttää jopa kaksi elektronia, joissa on kvantti -spin -numerot s = +½ ja s = -½.
Esimerkiksi natriumionilla on 10 elektronia, ts. Jos viitataan edelliseen lukuun, jokaiselle kiertoradalle on kaksi elektronia.
Mutta jos se on neutraali natriumiatomi, on 11 elektronia, joista viimeinen miehittäisi 3S -kiertoradan (ei esitetty kuvassa ja suurempi säde kuin 2S). Atomin kehrä on ratkaiseva aineen magneettisissa ominaisuuksissa.
Viitteet
- Alonso - Finn. Kvantti- ja tilastolliset perusteet. Addison Wesley.
- Eisberg - Resnick. Kvanttifysiikka. Limusa - Wiley.
- Gasiorowicz. Kvanttifysiikka. John Wiley & Sons.
- HSC. Fysiikan kurssi 2. Jacaranda Plus.
- Wikipedia. Schrodinger Atom -malli. Toipunut: Wikipedia.com

