Lyijynitraattirakenne, ominaisuudet, hankkiminen, käyttö

- 3673
- 1085
- Louis Moen
Hän nitraatti o Lyijy -nitraatti (II) on epäorgaaninen yhdiste, joka on muodostanut lyijyelementit (PB), typpi (N) ja happi (O). Lyijy löytyy ionina PB2+ Ja typpi ja happi muodostavat nitraatti -ionin3-.
Sen kemiallinen kaava on PB (ei3-A2. Se on valkoinen kiteinen2+ ja ei3-. Se tunnetaan myös nimellä Plumbose -nitraatti, koska lyijy on alhaisimmassa hapettumistilassaan.
 Vankka lyijy -nitraatti. Ondřej Mangl / Pub -verkkotunnus. Lähde: Wikimedia Commons.
Vankka lyijy -nitraatti. Ondřej Mangl / Pub -verkkotunnus. Lähde: Wikimedia Commons. Sillä on voimakkaasti hapettavia ominaisuuksia, joten sitä käytetään sovelluksissa, joissa tämä ominaisuus vaaditaan, kuten erilaisten orgaanisten yhdisteiden valmistuksessa ja laboratorioreagenssina.
Aikaisemmin sitä käytettiin laajasti lyijypohjaisten värien valmistamiseen, missä se toimi myös kudoksissa olevien värien kiinnittimena. Tämä hakemus hylättiin johtavan myrkyllisyyden vuoksi.
Sitä on käytetty metallurgisessa teollisuudessa monin tavoin, ja viime aikoina sen hyödyllisyyden on havaittu muodostuvan yhdessä muiden yhdisteiden kanssa, materiaalit, joilla on korkea valon imeytymiskapasiteetti ja tämän muuntaminen sähköllä.
Se on kuitenkin vaarallinen aine, koska se voi suosia tulentuotantoa. Se on myös myrkyllistä ihmiselle, eläimille ja kasveille, joten sitä ei tule koskaan hylätä ympäristössä.
[TOC]
Rakenne
Se on ioninen yhdiste, joka on muodostettu PB -kationilla2+ ja kaksi anionia ei3-. Nitraattien anionihapessa on järjestetty symmetrisesti typen ja vaihtoehtoisen kaksoissidoksen ympärille tämän kanssa.
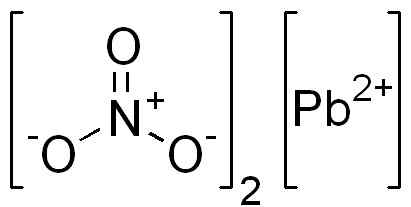 PB -rakenne (ei3-A2. Edgar181 / pubi -verkkotunnus. Lähde: Wikimedia Commons.
PB -rakenne (ei3-A2. Edgar181 / pubi -verkkotunnus. Lähde: Wikimedia Commons. 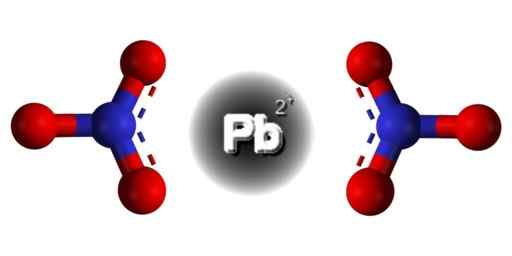 PB: n alueellinen rakenne (ei3-A2. Harmaa = lyijy; sininen = typpi; Punainen = happi. Claudio Pistilli/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons.
PB: n alueellinen rakenne (ei3-A2. Harmaa = lyijy; sininen = typpi; Punainen = happi. Claudio Pistilli/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons. Lyijy tässä yhdisteessä on seuraava elektroninen kokoonpano:
[Xe] 4F14 5d -d10 6s2 6p0 -, missä havaitaan, että se on menettänyt viimeisen kerroksen 2 elektronia.
Voi palvella sinua: mikä on elektronegatiivisin elementti ja miksi?Nimikkeistö
- Nitraatti
- Lyijy nitraatti (II)
- Plumboso -nitraatti
- Johtava dinitraatti
Ominaisuudet
Fyysinen tila
Valkoinen tai väritön kiteinen kiinteä. Kuutiokiteet.
Molekyylipaino
331 g/mol
Sulamispiste
470 ºC. Joidenkin lähteiden mukaan se hajoaa tässä lämpötilassa.
Tiheys
4,53 g/cm3
Liukoisuus
Hyvin liukoinen veteen: 59,7 g/100 ml vettä 25 ° C: ssa. Liukenee hiukan etanoliin. Liukenematon typpihappoon (HNO3) keskitetty.
PHE
Vesiliuos, jossa on 20% PB (ei3-A2 Sen pH on 3,0-4,0.
Kemialliset ominaisuudet
On hapettava aine. Reagoi väkivaltaisesti palavien materiaalien ja pelkistimien kanssa.
Se ei ole polttoainetta, mutta voi nopeuttaa materiaalien palamista. Jos lämmität sen hajoamiseen, säteilee myrkyllisiä typpioksidikaasuja:
2 PB (ei3-A2 + Lämpö → 2 pbo + 4 ei2↑ + O2↑
Kun se liukenee veteen, se ionisoidaan:
PB (ei3-A2 + H2O → pb2+ + 2 Ei3-
Saada
Se voidaan valmistaa reagoimalla metallinen lyijy, lyijy -monoksidi (PBO) tai lyijykarbonaatti3 Typpihapolla. On kätevää käyttää happoa ylimääräisiä nitraattien estämiseksi.
PBO + 2 HNO3 (keskittynyt) → PB (ei3-A2↓+ H2JOMPIKUMPI
Sovellukset
Orgaanisessa
Sen hapettumiskyky on levitettävä eri yhdisteiden valmistuksessa.
Sitä on käytetty kalixarenosien syntetisointiin, jotka ovat orgaanisia yhdisteitä, joiden molekyyli on korin muoto, joka sallii muiden aineiden sijoittamisen käytöstä, joka sille annetaan.
Se palvelee isotiokianaattien (R-CS) hankkimista amiineista (R-NH2-A.
Sitä käytetään teollisessa mittakaavassa bentsaldehydin hapettavan benchilokloridin valmistamiseksi. Se toimii myös katalysaattorina orgaanisten yhdisteiden esteröimiseksi, esimerkiksi polyesterien saamiseksi.
Kemiallisessa analyysissä
Sitä käytetään reagenssina alumiinin määrittämisessä ja johtaen mineraaleissa ja kivissä.
Tekstiilikuitujen värissä
Jotkut kromivärit vaativat PB: n käyttöä (ei3-A2 saada haltuunsa. Esimerkiksi puuvillan keltaisen värjäytymiseksi se on peitetty lyijy -nitraatilla ja käsitellään natriumsulfaatilla lyijysulfaatin tuottamiseksi.
Voi palvella sinua: vastaava painoSitten laimennettu natriumdikromaattiliuos levitetään lyijykromaatin muodostamiseksi (PBCRO4) Se on keltainen pigmentti.
 Aika sitten keltaiset kankaat värjättiin pigmenteillä, joiden lähtökohta oli PB (ei3-A2. Tätä ei tehdä lyijymyrkyllisyydellä. Kirjoittaja: 3D -animaatiotuotantoyhtiö. Lähde: Pixabay.
Aika sitten keltaiset kankaat värjättiin pigmenteillä, joiden lähtökohta oli PB (ei3-A2. Tätä ei tehdä lyijymyrkyllisyydellä. Kirjoittaja: 3D -animaatiotuotantoyhtiö. Lähde: Pixabay. Nykyään niiden myrkyllisyyden johtavat pigmentit on kuitenkin lopetettu.
Se toimii myös petoksena väriaineiden kiinnittämiseksi muun tyyppisten kuitujen värin tai tulostamisen aikana.
Medinan eläinlääkärissä
Sitä käytettiin aiemmin kaustisena aineena hevosten chancros- tai gangrrenien hoidossa.
Metalliteollisuudessa
Lyijynitraattia käytetään lyijyn elektrolyyttisessä jalostamisessa, aineena, joka suosii titaanin titaanin poistoa, mahdollistaa syanidiliuosten jalometallien palauttamisen, ja sitä käytetään PBO -elektrodissa2 Nickel Anodesissa.
Aurinkokennoissa
Sitä on käytetty vesiliuoksen muodossa aurinkokennojen valmistukseen Perovskitan, titaanioksidin mineraalin perusteella.
Syntetisoitu materiaali on lyijyjodidin organometalli tai pervskita, joka on kiinnittänyt tutkijoiden huomion, koska sillä on suuri valon imeytymiskyky ja kuormituskantajien suuri diffuusiopituus.
Nämä ominaisuudet tekevät siitä erinomaisen ehdokkaan aurinkosähkölaitteisiin, ts. Ne muuttavat valon sähkövirtaan.
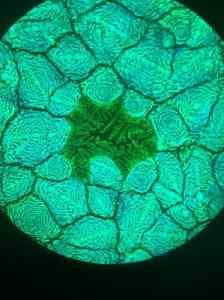 Fluoresenssimikroskoopilla otettu lyijyhalogenidi Unavskitan rakenteen mikrofotografia. Furava/cc by (https: // creativecommons.Org/lisenssit/by/4.0). Lähde: Wikimedia Commons.
Fluoresenssimikroskoopilla otettu lyijyhalogenidi Unavskitan rakenteen mikrofotografia. Furava/cc by (https: // creativecommons.Org/lisenssit/by/4.0). Lähde: Wikimedia Commons. Muut sovellukset
Hän (pbno3-A2 Sitä on myös käytetty:
- Otteluiden valmistuksessa tietyt räjähteet ja pyrotekniset materiaalit,
- Valokuvassa herkistävää aineena paperin peittämiseksi fototermografiassa,
- Tekstiiliteollisuudessa parantamaan rayonia ja stabiloimaan nylonia,
- Jyrsijöiden poistamisessa.
 Leadnitraattia on käytetty ilotulitusvälineiden tai pyroteknisen materiaalin valmistukseen. Kirjoittaja: vapaa-goos. Lähde: Pixabay.
Leadnitraattia on käytetty ilotulitusvälineiden tai pyroteknisen materiaalin valmistukseen. Kirjoittaja: vapaa-goos. Lähde: Pixabay. Riskejä
Tulipalo ja räjähdys
Vaikka se ei ole polttoaineyhdiste, jos se altistetaan tulille tai lämmölle, se voi räjähtää, tuottaen myrkyllisiä typpioksideja.
Koska on voimakkaasti hapettava aine, on vaara, että tulipalo syntyy, jos se joutuu kosketuksiin orgaanisten materiaalien kanssa.
Terveydelle
Tuottaa silmien ärsytystä, hengitys- ja ruoansulatuskanavia. Se on myrkyllistä hengittämällä ja nauttimisella. Yleisimmät tämän yhdisteen myrkytysoireet ovat maha -suolikanava, koliikki, ummetus ja heikkous, joista voi tulla muun muassa joidenkin lihaksien halvaus.
Sen nauttiminen voi myös aiheuttaa kipua, kouristuksia, masennusta, koomaa ja kuolemaa.
Luonnonympäristölle
Se on myrkyllistä vesi- ja maa -organismeille, lisäksi niiden vahingot ovat pysyviä ja bioakcumula elävissä olennoissa, joten sitä pidetään vaarallisena epäpuhtauksena, eikä sitä pidä hylätä ympäristölle.
Jos se on vahingossa vettä vuotanut, se tulisi neutraloida kalsiumoksidilla (CAO), kalsiumkarbonaatilla (Caco3) tai natriumbikarbonaatti (NAHCO3-A.
On vahvistettu, että se on karsinogeeni eläimille ja mahdollisesti ihmiselle.
Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Lyijy (ii) nitraatti. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Hsih, t.JA. et al. (2015). Tehokas posvskite aurinkokenno, joka on valmistettu käyttämällä vesipitoista nitraatin esiastetta. Chem Commun (Change). 2015 4. syyskuuta; 51 (68): 13294-7. NCBI toipunut.Nlm.NIH.Hallitus.
- Vratny, f. ja gugliotta, f. (1963). Lyijyn nitraatin rappeutuminen. J -. Inorg. Nukl. Kemia., 1963, vol. 25, pp. 1129-1132. ScienEdirect.com.
- Chakraborty, J.N. (2014). Värjäys mineraaliväreillä. Tekstiilien väriä ja käytäntöjä. ScienEdirect.com.
- Kumari, H. ja Atwood, J. (2017). Kalixareenit kiinteässä tilassa. Viite moduloidaan kemiassa, molekyylitieteissä ja kemian tekniikassa. ScienEdirect.com.
- Jeffery, P.G. ja Hutchison, D. (1981). Alumiini. Kemiallisissa kallioanalyysimenetelmissä (kolmas painos). ScienEdirect.com
- Sandler, S.R -. ja Karo, W. (1992). Syaanaatit, isosyanaatit, tiosyanaatit ja isotiosyanaatit. Edistyneiden orgaanisten laboratoriovalmisteiden lähdekirja. ScienEdirect.com.
- Smith, P.W -.G. et al. (1969). Aromaattiset halogeeniyhdisteet. Aromaattisessa kemiassa. ScienEdirect.com.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Lyijy, d.R -. (Toimittaja) (2003). CRC: n kemian ja fysiikan käsikirja. 85th CRC -lehdistö.
- Wikimedia -säätiö (2020). Lyijy (ii) nitraatti. Haettu jstk.Wikipedia.org.
- Shinde, D.V. et al. (2017). Vesipitoisen lyijy-nitraattipohjaisen organometallilisen perovskite-aurinkosolujen tehostettu teho ja stabiilisuus. ACS -omena. Äiti. 2017 rajapinnat, 9, 14023-14030. Pubista toipunut.ACS.org.
- « Fenolit tai fenoliyhdisteet ominaisuudet, tyypit, sovellukset
- Lyijyasetaatirakenne, ominaisuudet, hankkiminen, käyttö »

