Molekyylin happirakenne, ominaisuudet, käyttö
- 4063
- 865
- Kelly Kilback
Hän Molekyyli jompikumpi Dioksien, Kutsutaan myös diatomiseksi tai kaasumaiseksi happea, se on yleisin alkuaine, jossa tämä elementti löytyy maapallosta. Sen kaava on tai2, Siksi on diatominen ja homonukleaarinen molekyyli, täysin apolaarinen.
Hengittämämme ilma koostuu noin 21% hapesta molekyyleinä tai2. Mitä enemmän nousemme, kaasun hapen pitoisuudet vähenevät ja lisäämme otsonin esiintymistä tai3. Kehomme hyödyntää O: ta2 Happea kudokset ja suorittaa solun hengitys.
 Ilmakehän elämäämme rikastuttamatta happea olisi kestämätön ilmiö. Lähde: Pixabay.
Ilmakehän elämäämme rikastuttamatta happea olisi kestämätön ilmiö. Lähde: Pixabay. O2 Hän on myös vastuussa tulipalon olemassaolosta: ilman häntä olisi melkein mahdotonta saada tulipaloja ja paloja. Tämä johtuu siitä, että sen pääominaisuuden on oltava voimakas hapettava aine, voitti elektronit tai vähentää vesimolekyyliä tai oksidianioneja tai2-.
Molekyylihappi on välttämätöntä lukemattomille aerobisille prosesseille, joilla on sovelluksia metallurgia-, lääketieteen ja jäteveden hoidossa. Tämä kaasu on käytännössä synonyymi lämmölle, hengitykselle, hapettumiselle ja toisaalta jäädytetyille lämpötiloille, kun se on nestemäisessä tilassaan.
[TOC]
Molekyylin happirakenne
 Kaasumainen happimolekyylirakenne. Lähde: Benjah-BMM27 Wikipedian kautta.
Kaasumainen happimolekyylirakenne. Lähde: Benjah-BMM27 Wikipedian kautta. Yläkuvassa meillä on kaasumaisen hapen molekyylirakenne, jota edustaa useilla malleilla. Kahden viimeisen kovalenttisen sidoksen ominaisuudet, jotka pitävät happiatomeja, todistetaan: kaksoissidos O = O, jossa kukin happiatomi täydentää Valencian oktettinsa.
Voi palvella sinua: diastreeomeritMolekyyli tai2 Se on lineaarinen, homonukleaarinen ja symmetrinen. Sen kaksoissidos on pituus 121 pm. Tämä lyhyt etäisyys tekee tietyn huomattavan energian (498 kJ/mol) linkin O = O katkaisemiseksi, ja siksi se on suhteellisen vakaa molekyyli.
Jos näin on, ilmakehän happi olisi täysin hajoannut ajan myötä, tai ilma syttelee tuleen mihinkään.
Ominaisuudet
Fyysinen ulkonäkö
Molekyylihappi on väritön, mauton ja hajuton kaasu, mutta tiivistävä ja kiteyttäminen saa sinisiä sävyjä.
Moolimassa
32 g/mol (pyöristetty arvo)
Sulamispiste
-218 ºC
Kiehumispiste
-183
Liukoisuus
Molekyylihappi ei ole kovin liukeneminen veteen, vaan tarpeeksi tukemaan meren eläimistöä. Jos liukoisuus olisi suurempi, se kuolee vähemmän hukkumiseen. Toisaalta sen liukoisuus on paljon suurempi öljyissä ja apolaarisissa nesteissä, kykenevä hapettua ne hitaasti ja vaikuttavat siten niiden alkuperäisiin ominaisuuksiin.
Energiatilat
Molekyylihappi on aine, jota Valencia Link -teoria (TEV) ei voida täysin kuvata.
Elektroninen hapen kokoonpano on seuraava:
[He] 2S² 2p⁴
Siinä on pari puuttuvia elektroneja (tai :). Kun löytyy kaksi happiatomia, ne on kytketty muodostamaan kaksoissidos O = O, täydentämällä molemmat Valencian oktettia.
Siksi molekyyli tai2 Sen tulisi olla diamagneettinen, kaikilla parilla olevat elektronit. Se on kuitenkin paramagneettinen molekyyli, ja tämä selitetään sen molekyyliorbitaalien kaaviolla:
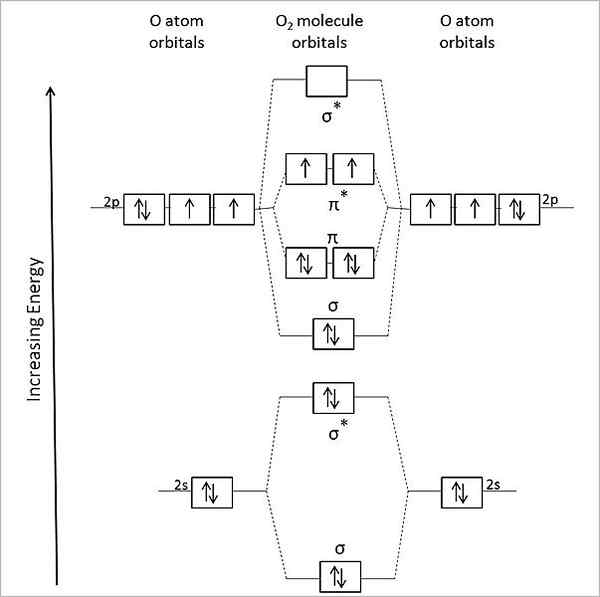 Kaasun happea. Lähde: Anthony.Sebastian/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0)
Kaasun happea. Lähde: Anthony.Sebastian/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0) Siten molekyylin kiertoradan teoria (TOM) kuvaa paremmin tai2. Kaksi puuttuvaa elektronia sijaitsevat molekyyliorbitaaleissa π*, suurempaa energiaa ja anna happea heidän paramagneettisen luonteensa kanssa.
Voi palvella sinua: metyyliamiini: rakenne, ominaisuudet, tuotanto, käyttötarkoituksetItse asiassa tämä energiatila vastaa kolminkertaista happea, 3JOMPIKUMPI2, Hallitsevin kaikista. Toinen hapen energiatila, vähemmän runsas maan päällä, on yksi, 1JOMPIKUMPI2.
Muutos
Molekyylihappi on huomattavasti stabiili niin kauan kuin se ei ole kosketuksessa minkään aineen kanssa, joka on alttiita hapettumiselle, paljon vähemmän, jos voimakkaan lämmön lähdettä ei ole, kuten kipinä. Tämä johtuu2 Sillä on suuri taipumus vähentää, saada elektroneja muista atomeista tai molekyyleistä.
Kun se on vähennetty, se pystyy luomaan laajan spektrin linkkejä ja muotoja. Jos se muodostaa kovalenttisia sidoksia, se tekee sen vähemmän elektronegatiivisilla atomilla kuin hän, mukaan. Se voi myös olla hiiliversumi, aiheuttaa C-O-sidoksia ja monen tyyppisiä hapetettuja orgaanisia molekyylejä (éteres, ketonit, aldehydit jne.-A.
O2 Voit myös saada elektroneja muuntamaan peroksideina ja superoksideina tai22- Minä2-, vastaavasti. Kun siitä tulee peroksidi organismissa, saadaan vetyperoksidi, H2JOMPIKUMPI2, H-O-O-H, haitallinen yhdiste, jota prosessoidaan spesifisten entsyymien (peroksidaasit ja katalas) vaikutuksella.
Toisaalta ja vähiten, O2 reagoi epäorgaanisen aineen kanssa tullakseen oksidianioniksi tai2-, Loputon luettelo mineralogisista massoista, jotka turvottavat kuoren ja maan vaipan.
Sovellukset
Hitsaus
 Happea käytetään asetyleenin palamiseen ja intensiivisen lämmön liekin tulemiseen, joka on arvokas hitsauksissa. Lähde: Sheila/CC by (https: // creativecommons.Org/lisenssit/by/2.0)
Happea käytetään asetyleenin palamiseen ja intensiivisen lämmön liekin tulemiseen, joka on arvokas hitsauksissa. Lähde: Sheila/CC by (https: // creativecommons.Org/lisenssit/by/2.0) Happea käytetään palamisreaktion suorittamiseen, jolla aine antaa eksotermisesti tulen. Tämä tulipalo ja sen lämpötila vaihtelevat palavan aineen mukaan. Siten voidaan saada erittäin kuumia liekkejä, kuten asetyleeni (yllä), joiden kanssa metallit ja seokset hitsataan.
Voi palvella sinua: entalpiaJos ei happea.
Hapettimeaine vihreässä kemiassa
Tämän kaasun ansiosta loputon orgaaniset ja epäorgaaniset oksidit syntetisoidaan tai tuotetaan teollisesti. Nämä reaktiot perustuvat molekyylin hapen hapettavaan voimaan, ja ne ovat myös yksi vihreän kemian elinkelpoisimmista reagensseista farmaseuttisten tuotteiden saamiseksi.
Avustettu hengitys- ja jäteveden hoito
Happi on elintärkeää vastaamaan hengityksen kysyntää potilailla, joilla on vakavia terveystiloja, sukeltajia, kun he laskeutuvat matalalla syvyydellä ja vuorikiipeilijöissä, joiden korkeudessa happipitoisuus näyttää dramaattisesti vähentyneen.
Samoin happea "ruokkii" aerobisia bakteereja, jotka auttavat heikentämään jätevesien saastumista tai auttavat hengittämään kaloja vesipitoisissa viljelykasveissa suojaamiseksi tai kauppaa varten.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2020). Hapen allotroopit. Haettu: vuonna.Wikipedia.org
- Hio, c.-Lla., Kappe, c.JOMPIKUMPI. (2019). Molekyylin hapen käyttö nestemäisessä faasissa aerobisissa hapettumisissa jatkuvassa virtauksessa. Top Curr Chem (Z)377, 2. doi.org/10.1007/S41061-018-0226-Z
- Kevin Beck. (28. tammikuuta 2020). 10 käyttöä happea. Toipunut: tiedekunnasta.com
- Kallio. (2020). Biokemia I: Molekyylin hapen kemia. Toipunut: Cliffsnotes.com
- GZ: n teollisuustarvikkeet. (2020). Happikaasun teollisuusetuja. Haettu osoitteesta: GZ-SPPLIES.com
- « Portugalin perinteiden, tapojen, gastronomian, uskonnon kulttuuri
- Tuhoava häiriökaava ja yhtälöt, esimerkit, liikunta »

