Isocoric -prosessi
- 3262
- 661
- Louis Moen
Mikä on isocoric -prosessi?
Eräs Isocoric -prosessi Se on mikä tahansa termodynaaminen prosessi, jossa tilavuus pysyy vakiona. Nämä prosessit saavat usein myös isometrisen tai isovolumetrisen nimen. Yleensä termodynaaminen prosessi voi tapahtua vakiopaineessa, ja sitä kutsutaan sitten isobariksi.
Kun se tapahtuu vakiona lämpötilassa, siinä tapauksessa sanotaan, että se on isoterminen prosessi. Jos järjestelmän ja ympäristön välillä ei ole lämmönvaihtoa, adiabaattisesta puhetaan. Toisaalta, kun on vakio tilavuus, tuotettu prosessia kutsutaan isocoriksi.

Isocoric-prosessin tapauksessa voidaan vahvistaa, että näissä prosesseissa paine-tilavuustyö on tyhjä, koska tämä johtuu paineen kertomisesta tilavuuden lisääntymisen myötä.
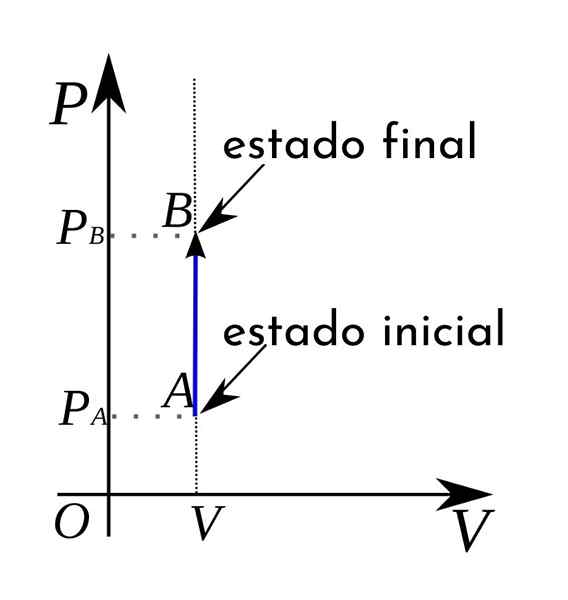
Lisäksi termodynaamisessa paine-tilavuuskaaviossa isokorjaiset prosessit esitetään pystysuoran suoran linjan muodossa.
Kaavat ja laskelmat
Termodynamiikan ensimmäinen periaate
Termodynamiikassa työ lasketaan seuraavasta lausekkeesta:
W = p ∙ ∆ V
Tässä lausekkeessa W on Joulesissa mitattu työ, P paine, joka mitataan Newtonissa neliömetriä kohti, ja ∆ V on kuutiometrien mitatun tilavuuden vaihtelu tai lisääntyminen.
Samoin termodynamiikan ensimmäinen periaate osoittaa sen:
∆ u = q - w
Tässä kaavassa se on järjestelmän tai järjestelmän tekemä työ, joka on järjestelmän vastaanottama tai myöntämä lämpö, ja ∆ u Se on järjestelmän sisäinen energian vaihtelu. Tässä yhteydessä kolme suuruutta mitataan Joulesissa.
Koska isocoric -prosessissa työ on nolla, osoittautuu, että on täytettävä, että:
Voi palvella sinua: Neptune (planeetta)∆ u = qV (koska ∆ V = 0, ja siksi w = 0)
Toisin sanoen järjestelmän sisäinen energian vaihtelu johtuu vain lämmönvaihdosta järjestelmän ja ympäristön välillä. Tässä tapauksessa siirrettyä lämpöä kutsutaan lämpöä vakiotilavuuteen.
 Lämpökapasiteetti vakiotilavuudella
Lämpökapasiteetti vakiotilavuudella
Kehon tai järjestelmän lämpökapasiteetti johtuu energian määrän jakamisesta keholle tai järjestelmään siirretyn lämmön muodossa tietyssä prosessissa ja saman kokemuksen lämpötilan muutos.
Kun prosessi suoritetaan vakiotilavuudella, se puhutaan lämpökapasiteetista vakiotilavuuteen ja se merkitään cv (molaarinen lämpökapasiteetti).
Se täyttyy siinä tapauksessa:
Q -v = N ∙ cv ∙ ∆t
Tässä tilanteessa n on moolien lukumäärä, cv Se on edellä mainittu lämpökapasiteetin molaari vakiotilavuuteen ja ∆T on kehon tai järjestelmän kokeman lämpötilan nousu.
Päivittäiset esimerkit isocoric -prosesseista
Isocoric -prosessin kuvitella on helppo kuvitella, on tarpeen ajatella vain prosessia, joka tapahtuu vakiotilalla; toisin sanoen, jossa materiaali- tai materiaalijärjestelmää sisältävä säiliö ei muuta äänenvoimakkuutta.
Esimerkki voi olla, että suljettuun säiliöön lukittuna (ihanteellinen) ei voida muuttaa millään tavalla, joka toimitetaan lämpöä. Oletetaan, että pulloon lukitun kaasun tapaus.
Siirtämällä lämmön kaasuun, kuten jo selitettiin, se lopulta johtaa sen sisäisen energian lisääntymiseen tai lisääntymiseen.
Käänteinen prosessi olisi säiliössä suljettu kaasu, jonka tilavuutta ei voida muuttaa. Jos kaasu jäähtyy ja antaa lämpöä ympäristölle, kaasun paine ja kaasun sisäisen energian arvo vähenevät.
Se voi palvella sinua: Diskreetti muuttuja: Ominaisuudet ja esimerkitIhanteellinen sykli Otto
Otto -sykli on ihanteellinen tapaus syklistä, jota bensiinikoneet käyttävät. Sen alkuperäinen käyttö oli kuitenkin koneissa, joissa käytettiin maakaasua tai muita polttoaineita kaasumaisessa tilassa.
Joka tapauksessa Oton ihanteellinen sykli on mielenkiintoinen esimerkki isocorisesta prosessista. Se tapahtuu polttoautossa, bensiini- ja ilmaseoksen palaminen tapahtuu hetkessä.
Tällöin sylinterin lämpötilan ja kaasun paineen nousu tapahtuu vakiotilavuuden pysyväksi.
Käytännön esimerkit
Ensimmäinen esimerkki
Kun otetaan huomioon kaasu (ihanteellinen), joka on lukittu sylinteriin, joka on varustettu männän kanssa.
- 500 J: n työpaikka on tehty.
Tässä tapauksessa se ei olisi isokorjainen prosessi, koska kaasun työn tekeminen on välttämätöntä puristaa se, ja siksi sen tilavuus.
- Kaasu laajenee männän vaakasuoraan.
Jälleen se ei olisi isokorjainen prosessi, koska kaasun laajennus merkitsee sen tilavuuden vaihtelua.
- Sylinterimäntä on kiinnitetty siten, että kaasua ei voida siirtää ja kaasu jäähdytetään.
Tässä yhteydessä se olisi isokorjainen prosessi, koska tilavuuden vaihtelua ei olisi.
Toinen esimerkki
Määritä sisäisen energian variaatio, jolla on kaasu, joka sisältyy astiaan, jonka tilavuus on 10 litraa 1 atm: n paineeseen, jos sen lämpötila nousee 34 ºC: sta 60 ° C: seen isocoric -prosessissa, tunnet sen spesifisen lämpömolaarisen lämpöä Cv = 2.5 ·R - (oleminen R - = 8.31 j/mol · k).
Se voi palvella sinua: Graff Van Generaattori: Juhlat, miten se toimii, sovelluksetKoska se on vakiotilavuusprosessi, sisäinen energian vaihtelu tapahtuu vain kaasulle toimitetun lämmön seurauksena. Tämä määritetään seuraavalla kaavalla:
Q -v = N ∙ cv ∙ ∆t
Toimitetun lämmön laskemiseksi on ensin tarpeen laskea säiliön sisältämät kaasun moolit. Tätä varten on välttämätöntä turvautua ihanteellisten kaasujen yhtälöön:
P ∙ v = n ∙ r ∙ t
Tässä yhtälössä n on moolien lukumäärä, R on vakio, jonka arvo on 8,31 j/mol · k, t on lämpötila, p on paine, johon ilmakehässä mitattu kaasu ja t alistetaan ja t on mitattu lämpötila Kelvinissä.
Se puhdistetaan ja saadaan:
n = r ∙ t/ (p ∙ v) = 0, 39 moolia
Jotta:
∆ u = qV = N ∙ cv ∙ ∆t = 0,39 ∙ 2,5 ∙ 8,31 ∙ 26 = 210,65 J

