Keratiinityypit, rakenne, sijainti ja toiminnot
- 1249
- 35
- Sheldon Kuhn
Se keratiini Se on liukenematon kuituproteiini, joka on solujen rakenteellinen osa ja monien organismien, etenkin selkärankaisten eläinten, kokonaisuudet. Sillä on hyvin monipuolisia muotoja ja se on vähän reaktiivista, kemiallisesti.
Sen rakenteen kuvasivat ensin tutkijat Linus Pauling ja Robert Corey vuonna 1951, kun analysoivat eläinten hiusten rakennetta. Nämä tutkijat antoivat myös viitteitä lihaskudoksen myosiinin rakenteesta
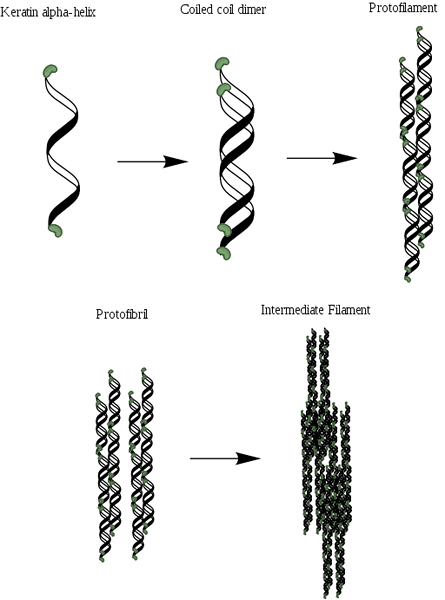
 Alfa-Queratiinin organisaatiojärjestelmä (lähde: Mlpatton [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Alfa-Queratiinin organisaatiojärjestelmä (lähde: Mlpatton [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Kollageenin jälkeen se on yksi eläinten tärkeimmistä proteiineista ja edustaa suurinta osaa hiusten, villan, kynsien, kynsien ja sorkkien, höyhenten, sarvien ja huomattavan osan ihon ulkokerroksen ja huomattavan osaa.
Eläinten "keratinisoiduissa" elementeissä voi olla hyvin erilaisia morfologioita, jotka riippuvat suurelta osin kussakin tietyssä organismissa toimittavasta toiminnasta.
Keratiini on proteiini, jolla on ominaisuuksia, jotka antavat sille suuren mekaanisen tehokkuuden jännityksen ja puristuksen suhteen. Sitä tuottaa erityinen solutyyppi, jota kutsutaan "keratinosyyteiksi", jotka yleensä kuolevat sen valmistuksen jälkeen.
Jotkut kirjoittajat väittävät, että kerainit ilmaistaan kangas- ja lavastadionilla. Ihmisillä näille proteiineille on yli 30 koodaavaa geeniä, ja nämä kuuluvat perheeseen, joka kehittyi useiden geneettisen kopioinnin kierroksille.
[TOC]
Tyypit keratiinit ja niiden rakenne
Keratiineja on käytännössä kahta tyyppiä: α ja β. Nämä erotetaan hallussaan perusrakenne, joka koostuu pääasiassa polypeptidiketjuista, jotka voidaan ilmoittautua alfa-potkuriksi (α-queratinas) tai liittyä rinnakkain kuin β-laskennalliset arkit (β-halkeama)).
α-queratinas
Tämäntyyppinen keratiini on tutkittu eniten ja tiedetään, että nisäkkäillä on vähintään 30 erilaista tämän tyyppistä keratiinia. Näissä eläimissä α-ne ovat osa kynnejä, hiuksia, sarvia, kypärää, piikkejä ja orvaskeutta.
Kuten kollageeni, nämä proteiinit sisältävät rakenteessaan runsaasti osuutta pienistä aminohapoista, kuten glysiini ja alaniini, jotka ovat ne, jotka tekevät mahdolliseksi alfapotkurien perustamisen. A-kikeratiinin molekyylirakenne koostuu kolmesta eri alueesta: (1) kiteiset fibrillit tai potkurit, (2) filamenttien päätedomeenit ja (3) matriisi.
Potkurit ovat kaksi ja muodostavat dimeerin, joka muistuttaa kelattua spiraalia, joka pysyy yhtenäisenä linkkien tai disulfuriltojen (S-S) läsnäolon ansiosta. Jokaisella potkurilla on noin 3.6 aminohappojäte jokaisessa käännöksessä, joka antaa ja koostuu enemmän tai vähemmän 310 aminohappoa.
Se voi palvella sinua: Ecuadorian Sierran kasvisto ja eläimistö: edustavat lajitNämä kelatut spiraalit voidaan sitten yhdistää rakenteen muodostamiseen, joka tunnetaan nimellä protofilamentti tai protofibrilla, jolla on kyky koota muiden samantyyppisten kanssa.
Protofilamenteilla on N- ja C-terminaalit Ei-kierteiset päät, joissa on runsaasti kysteiinitähteitä ja jotka on kiinnitetty keskusalueelle tai matriisiin. Nämä molekyylit polymeroivat muodostaen välituotteet, joiden halkaisija on lähellä 7 nm.
Keratiinista koostuvat kaksityyppistä välituotteita erottuvat: happamat filamentit (tyyppi I) ja perusteet (tyyppi II). Nämä upotetaan proteiinimatriisiin ja tapa, jolla nämä filamentit järjestetään, vaikuttavat suoraan muodostavan rakenteen mekaanisiin ominaisuuksiin.
Tyypin I filamenteissa potkurit ovat yhteydessä toisiinsa kolmella ”kierteisellä liittimellä”, joka tunnetaan nimellä L1, L12 ja L2 ja joiden ajatellaan tarjoavan joustavuutta kierteiselle alueelle. Tyypin II filamenteissa on myös kaksi aliverkkotunnusta, jotka ovat kierteisten alueiden joukossa.
Esimerkki α-queratinas-rakenteesta: hiukset
Jos tyypillisten hiusten rakenne analysoidaan, sen halkaisija on likimääräinen 20 mikronia ja koostuu kuolleista soluista.
 Nisäkkäiden hiukset, kuten tämä lehmä, koostuu keratiinista (lähde: Frank Winkler Pixabayn kautta.com)
Nisäkkäiden hiukset, kuten tämä lehmä, koostuu keratiinista (lähde: Frank Winkler Pixabayn kautta.com) Makropibrillit koostuvat mikrofibrilleistä, joiden halkaisija on vähemmän ja jotka on liitetty toisiinsa amorfisen proteiiniaineen kautta, jolla on korkea rikkipitoisuus.
Nämä mikrofibrillit ovat pienempien protofibrillien ryhmiä, joilla on 9+2 -organisaatiokuvio, mikä tarkoittaa, että yhdeksän protofibrillaa ympäröi kaksi keskusprotofibrilliä; Kaikki nämä rakenteet koostuvat olennaisesti α-queratiinista.
Pehmeät keratiinit ja kovat keratiinit
Niiden rikkipitoisuudesta riippuen α-queratinas voidaan luokitella pehmeiksi keratiiniksi tai koviksi keratiiniksi. Tämä liittyy disulfidiyhteyksien asettamiin mekaaniseen resistenssivoimiin proteiinirakenteessa.
Kovien keratiinien ryhmään ne, jotka ovat osa hiuksia, sarvet ja kynsi.
Disulfidisidokset voidaan eliminoida soveltamalla pelkistävää aineita, joten keratiinista koostuvat rakenteet eivät ole helposti sulavia, ellei niillä ole suolia, joissa on runsaasti tavaroita, kuten joidenkin hyönteisten kanssa tapahtuu.
Se voi palvella sinua: fikologiaβ-queratinas
Β-se on paljon vahvempi kuin a-queratinas ja niitä löytyy matelijoista ja lintuista osana kynnet, asteikot, höyhenet ja piikit. Gekosissa jalkojensa (sienet) löydetyt mikrovirrat koostuvat myös tästä proteiinista.
Sen molekyylirakenne koostuu β-verkosta, joka muodostuu antiparalleted-polypeptidiketjuista, jotka sitoutuvat yhteen sidoksien tai vetysitojen kautta. Nämä ketjut, vierekkäin, muodostavat pieniä jäykkiä ja litteitä pintoja, hieman taitettuna.
Missä olet ja mitkä ovat tehtäväsi?
Keratiinifunktiot liittyvät ennen kaikkea sen rakentaman rakenteen tyyppiin ja eläimen rungon paikkaan, missä se sijaitsee.
Kuten muutkin kuituproteiinit, tämä antaa soluille stabiilisuuden ja rakenteellisen jäykkyyden, koska se kuuluu suureen proteiinin perheeseen, joka tunnetaan välituotteiden filamenttien perheeksi, jotka ovat sytoskeleton proteiineja.
Suojelu- ja kattavuudessa
Yläeläinten ihon yläkerroksella on Keratiinin muodostama suuri välifilamenttiverkko. Tätä kerrosta kutsutaan orvaskeiksi, ja ihmisillä on välillä 30 mikronia ja 1 nm paksu.
Overrommi toimii suojaesteinä erityyppisiä mekaanisia ja kemiallisia stressiä vastaan ja syntetisoidaan erityistyyppisellä soluilla, joita kutsutaan "keratinosyyteiksi".
Orvaskeden lisäksi on vielä enemmän ulkoista kerrosta, joka liikkuu jatkuvasti.
Eri eläimet käyttävät myös Espinasia ja Púasia omaan suojaan petoeläimiä ja muita aggressoreita vastaan.
Pangoliinien "panssari", jotkut pienet hyönteisiä nisäkkäitä, jotka asuvat Aasiassa ja Afrikassa, koostuvat myös keratiinin "asteikoista", jotka suojaavat heitä.
Puolustuksessa ja muissa toiminnoissa
Sarvia havaitaan Bovidae -perheen eläimissä, toisin sanoen lehmissä, lampaissa ja vuohissa. Ne ovat erittäin vahvoja ja vastustuskykyisiä rakenteita, ja eläimet, jotka saavat heidät, käyttävät niitä puolustus- ja kohteliaisuuseliminä.
Sarvet muodostetaan luukeskuksella, joka koostuu "sienistä" luusta, joka peittää ihon, joka on projisoitu kallon takavyöhykkeestä.
 Kynnet ovat toinen esimerkki keratiinista koostuvista kehon osista (lähde: Adobe Stock Pixabayn kautta.com)
Kynnet ovat toinen esimerkki keratiinista koostuvista kehon osista (lähde: Adobe Stock Pixabayn kautta.com) Kynnet ja kynät ruokaa ja tukensa toimintojensa lisäksi myös eläimiä "aseiden" puolustuksina hyökkääjiä ja petoeläimiä vastaan.
Voi palvella sinua: Fixist -teoria: Konsepti, postulaatit ja kirjoittajatBird Peaks toteuttaa useita tarkoituksia, joista ruoka, puolustus, kohteliaisuus, lämmönvaihto ja wc, muun muassa, muun muassa. Lintujen PICOS -lajikkeita löytyy luonnosta, etenkin niihin liittyvien leuan muodon, värin, koon ja voimakkuuden suhteen.
Piikit koostuvat, samoin kuin sarvet, luukeskuksella, joka on projisoitu kallosta ja joka on peitetty resistentteillä β-queratiiniarkkeilla.
Vaikuttamattomien eläinten ("esi -isien" selkärankaisten) hampaat koostuvat keratiinista ja kuten "ylemmien" selkärankaisten hampaissa on useita toimintoja ruoassa ja puolustuksessa.
Liikkeessä
Monien märehtijöiden ja ugneloitujen eläinten kypärät (hevoset, aasit, alces jne.) Ne koostuvat keratiinista, ne ovat erittäin kestäviä ja suunniteltuja jalkojen suojaamiseksi ja liikkeessä yhteistyöhön.
Höyhenet, joita lintujen käyttäminen myös liikkumiseen, koostuvat β-halusta. Näillä rakenteilla on lisäksi toiminnot naamioinnissa, kohteliaisuudessa, lämpöeristyksessä ja päättämättömyydessä.
 Höyhenet ja lintujen huippu koostuvat myös keratiinista (lähde: Couleur, Pixabayn kautta.com)
Höyhenet ja lintujen huippu koostuvat myös keratiinista (lähde: Couleur, Pixabayn kautta.com) Teollisuudessa
Tekstiiliteollisuus on yksi keratinisoitujen rakenteiden tärkeimmistä hyväksikäytöistä, antroposendisesti ottaen. Monien eläinten villa ja hiukset ovat tärkeitä teollisuustasolla, koska heidän kanssaan valmistetaan erilaisia vaatteita, jotka ovat hyödyllisiä miehille eri näkökulmista.
Viitteet
- Koolman, J., & Roehm, K. (2005). Biokemian väri (2. painos.-A. New York, USA: Thieme.
- Mathews, c., Van Holde, K., & Ahern, k. (2000). Biokemia (3. ed.-A. San Francisco, Kalifornia: Pearson.
- Nelson, D. Lens., & Cox, M. M. (2009). Lehninger -biokemian periaatteet. Omega -versiot (5. ed.-A.
- Pauling, L., & Corey, R. (1951). Hiusten, lihaksen ja siihen liittyvien proteiinien rakenne. Kemia, 37, 261-271.
- Phillips, D., Korge, b., & James, W. (1994). Keratiini ja keratinisointi. Amerikan dermatologian akatemian lehti, 30(1), 85-102.
- Rouse, j. G., & Dyke, M. JA. Mennä. (2010). Katsaus keratiinipohjaisiin biomateriaaleihin biolääketieteellisiin sovelluksiin. Materiaalit, 3, 999-1014.
- Smith, f. J -. D -d. (2003). Keratiinihäiriöiden molekyyligenetiikka. Am J Clin Dermatol, 4(5), 347-364.
- Voet, D., & Voet, J. (2006). Biokemia (3. ed.-A. Pan -american lääketieteellinen toimitus.
- Wang, b., Yang, W., McKitrick, J., & Meyers, M. -Lla. (2016). Keratiini: rakenne, mekaaniset ominaisuudet, esiintyminen biologisissa organismeissa ja ponnisteluissa bioinspiraatiossa. Materiaatiotieteen edistyminen.

