Paristotyypit, ominaisuudet ja reaktiot

- 4814
- 981
- Kelly Kilback
Markkinoilla voit saada erilaisia Paristotyypit kanssa Hänen karakteristit oma. Paristot, jotka eivät ole muuta kuin voltaatisia soluja, tarjoavat kuluttajalle minkä tahansa paikan käytön etuna (edellyttäen, että olosuhteet eivät ole dramaattisia).
Yleensä akkuja voidaan ostaa eristettyjä; Mutta ne on kiinnitetty myös toisiinsa sarjassa tai rinnakkaisina, joiden sarja on se, mitä he kutsuvat akkuiksi. Ja niin joskus termejä 'paristoja' ja 'paristoja' käytetään yleensä erottelematta, vaikka ne eivät olisikaan samoja.
 Mealan akut: Yksi tunnetuimmista paristoista
Mealan akut: Yksi tunnetuimmista paristoista Paristoilla voi olla lukemattomia värejä, muotoja ja kokoja, kuten myös muista materiaaleista. Myös ja mikä tärkeintä, niiden sisäinen rakenne, jossa kehitetään sähköä tuottavat kemialliset reaktiot, erottuu ne toisistaan.
Esimerkiksi kolme alkaliparistoa, yksi yleisimmistä on esitetty ylemmässä kuvassa. Termi emäksinen viittaa siihen, että väliaine, jossa elektronien vapautuminen ja virtaus tapahtuu, on emäksistä; Eli sen pH on yli 7 ja OH -anionit ovat vallitsevia- ja muut negatiiviset maksut.
[TOC]
Pilas -luokitus
Ennen joidenkin erityyppisten paristojen käsittelemistä on tarpeen tietää, että nämä luokitellaan maailmanlaajuisesti ensisijaisiksi tai toissijaisiksi.
- Ensisijaiset akut
Ensisijaiset paristot ovat kuluneet, on hylättävä tai kierrätettävä, koska kemiallinen reaktio, jolla sähkövirta ylläpidetään, on peruuttamatonta. Siksi näitä ei voida ladata.
Niitä käytetään pääasiassa sovelluksissa, joissa on epäkäytännöllistä sähköenergian lataaminen; kuten sotilaslaitteissa, taistelukentän keskellä. Ne on suunniteltu myös laitteille, jotka kuluttavat vähän energiaa, niin että ne kestävät pidempään; Esimerkiksi kaukosäätimet tai kannettavat konsolit (Gameboy, Tetris ja Tamagotchi).
Elämäakut, toisen esimerkin mainitsemiseksi, kuuluu myös ensisijaiseen tyyppiin. Niillä on yleensä lieriömäisiä muotoja, vaikka tämä ei tarkoita, että lieriömäiset akut eivät voi olla toissijaisia tai ladattavia.
- Toissijaiset akut
Toisin kuin ensisijaiset akut, toissijaiset akut voidaan ladata, kun niiden energia on loppunut.
Tämä johtuu siitä, että niissä esiintyvät kemialliset reaktiot ovat palautuvia, ja siksi tietyn jännitteen levittämisen jälkeen se aiheuttaa tuotteiden uudelleentoiminnan uudelleen, aloittamaan reaktio uudelleen.
Jotkut toissijaiset akut (kutsutaan akkuiksi) ovat yleensä pieniä, samoin kuin ensisijaiset; Ne osoitetaan kuitenkin laitteille, jotka kuluttavat enemmän energiaa ja joille ensisijaisten akkujen käyttö olisi taloudellisesti ja energisesti. Esimerkiksi matkapuhelinparistot sisältävät toissijaisia akkuja.
Myös toissijaiset paristot on suunniteltu suurille laitteille tai piireille; Esimerkiksi auto -akut, jotka koostuvat useista paristoista tai voltaatisista soluista.
Ne ovat yleensä kalliimpia kuin ensisijaiset akut ja paristot, mutta pitkään aikavälillä ne lopulta ovat sopivampia ja tehokkaampia vaihtoehtoja.
- Muut näkökohdat
Paristot luokitellaan joko ensisijaiseen tai toissijaiseen; Mutta kaupallisesti tai yleisesti ne luokitellaan yleensä muodon mukaan (lieriömäiset, suorakaiteen muotoiset painikkeet) määritettyyn laitteeseen (kamerat, ajoneuvot, laskimet) heidän nimiinsä (AA, AAA, C, D, N, A23, jne. .), Ja IEC- ja ANSI -koodeihin.
Se voi palvella sinua: Pyridiini: rakenne, ominaisuudet, käytöt, toksisuus, synteesiMyös ominaisuudet, kuten sen jännite (1,2–12 volttia), samoin kuin niiden käyttöikä ja hinnat, ovat vastuussa tietyn luokituksen antamisesta kuluttajan silmissä.
Paalutyyppiluettelo
- Hiili-sinkki-akut
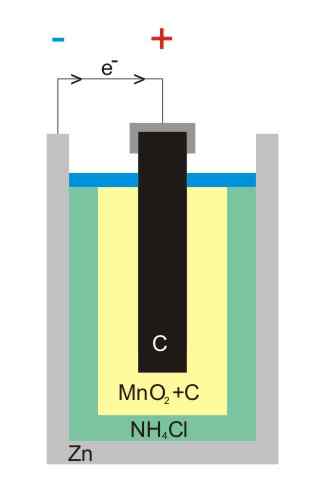 Sinkki-hiili-akku kuva
Sinkki-hiili-akku kuva Hiili-sinkki-akut (tunnetaan myös nimellä Leclanché tai Salinas Pilas -solut) ovat yksi primitiivisimmistä, ja niitä pidetään tällä hetkellä melkein käytöstä muiden akkujen edessä; Erityisesti alkalisten akkujen edessä, jotka ovat hiukan kalliimpia, niillä on elinikä ja suuret jännitteet.
Kuten nimestä voi päätellä.
Ensimmäisessä elektrodissa anodi on peräisin elektroneista metallisen sinkin hapettumisella. Nämä elektronit kulkevat sitten ulkoista piiriä, joka syöttää laitetta sähköllä ja päättyy sitten grafiittikatoriin, jossa sykli on valmis, kun mangaanidioksidi vähenee, missä se on upotettu.
Reaktiot
Elektrodissa esiintyvien reaktioiden kemialliset yhtälöt ovat:
Zn (s) → Zn2+(AC) + 2e- (Anodi)
2 mno2(s) + 2e- + 2 NH4CL (AC) → MN2JOMPIKUMPI3(S) + 2 NH3(AC) + H2Tai (l) + 2 cl- (AC) (katodi)
Nämä paristot ovat hyvin samankaltaisia kuin emäksinen: molemmat ovat lieriömäisiä (kuten kuvan akkuja). Hiili-sinkki-akut voidaan kuitenkin erottaa, jos ulkomailla merkityt ominaisuudet luetaan yksityiskohtaisesti tai jos IEC-koodiasi edeltää kirjaimella R. Sen jännite on 1,5 V.
- Emäksiset paristot
Alkaliparistot ovat hyvin samankaltaisia kuin hiili-sinkkistyypin, erolla, että väliaine, jossa elektrodit sisältävät OH-anionit-. Tämä väliaine koostuu vahvoista kaliumhydroksidin, KOH: n elektrolyytteistä, joka myötävaikuttaa OH- jotka osallistuvat ja "yhteistyössä" elektronien siirtymisessä.
Sitä on erikokoisia ja jännitteitä, vaikka yleisin on 1,5 V. Ne ovat ehkä markkinoiden tunnetuimpia akkuja (esimerkiksi Duracelli).
Heidän elektrodissa esiintyvät reaktiot ovat:
Zn (s) + 2OH-(aq) → zno (s) + h2Tai (l) + 2e- (Anodi)
2Mn2(s) + h2Tai (l) + 2e- → Mn2JOMPIKUMPI3(S) + 2OH-(aq) (katodi)
Lämpötilan noustessa reaktiot tapahtuvat nopeammin ja nopeammin paristot puretaan. Mielenkiintoista on, että heillä oli suosittu huhuja asettaakseen heidät pakastimeen pidentääkseen elävää aikaa; Mutta jäähdytettäessä sen sisältö voi kärsiä mahdollisista tiivistyksistä, jotka tuovat lisävaurioita tai riskejä mukanaan.
Elohopea
 Todennäköinen elohopea -akku, joka voidaan sekoittaa hopeaoksidiakkuun. Lähde: MultiCherry [CC0].
Todennäköinen elohopea -akku, joka voidaan sekoittaa hopeaoksidiakkuun. Lähde: MultiCherry [CC0]. Elohopea -akut ovat erittäin ominaisia johtuen niiden omituisesta hopeapainikkeiden häpeästä (ylivoimainen kuva). Lähes kaikki tunnistaisivat heidät ensi silmäyksellä. Ne ovat myös emäksisiä, mutta niiden katodi sisältää grafiitti- ja mangaanidioksidin lisäksi elohopeaoksidin, HGO: n; josta vähentämisen jälkeen tulee metallinen elohopea:
Zn (s) + 2OH-(Ac) → zno (s) + h2Tai (l) + 2e-
HGO (S) + H2O + 2e- → Hg (s) + 2OH-
Voi palvella sinua: Magnesiumoksidi: rakenne, ominaisuudet, nimikkeistö, käyttöHuomaa, kuinka näissä solureaktioissa OH -anionit kulutetaan ja uudistetaan-.
Pieninä akkuina se on tarkoitettu pienille esineille, kuten kelloille, laskimille, lelujen hallintalaitteille jne. Kuka on käyttänyt mitä tahansa näistä esineistä on huomannut, että paristoja ei tarvitse muuttaa melkein "ikuisuuden"; mikä olisi 10 vuotta vanha, suunnilleen.
Hopeaoksidi
 Hopeaoksidiakut. Lähde: Lukas A, CZE [julkinen alue].
Hopeaoksidiakut. Lähde: Lukas A, CZE [julkinen alue]. Elohopeaparistojen päävirhe on, että kun ne hylätään. Ehkä tästä puuttuu IEC- ja ANSI -koodeja. Hopeaoksidiakujen osalta sen IEC -koodia edeltää kirjain S.
Yksi elohopeaparistojen korvikkeista vastaa hopeaoksidin, paljon kalliimpaa, mutta vähemmän ekologista vaikutusta (ylivoimainen kuva). Alussa ne sisälsivät elohopeaa sinkin suojelemiseksi alkalista korroosiolta.
Se on saatavana jännitteellä 1,5 V, ja sen sovellukset ovat hyvin samanlaisia kuin Mercury Pilan sovellukset. Itse asiassa molemmat paristot näyttävät ensi silmäyksellä identtisiä; Vaikka hopeaoksidiakkuja voi olla paljon suurempia.
Elektrodien reaktiot ovat:
Zn (s) + 2OH-(AC) → Zn (OH)2(s) + 2 e-
Ag2Tai (s) + 2h+(AC) + 2e- → 2Ag (s) + H2Tai (l)
Myöhemmin vesi kärsii elektrolyysistä, joka hajoaa H -ioneihin+ ja oh-.
Huomaa, että elohopean sijasta se muodostuu metallihopeakatodista.
- Nickel-Cadmium Pilas (Nicad)
 Nikd -akku. Lähde: Lordider [CC0].
Nikd -akku. Lähde: Lordider [CC0]. Tästä hetkestä lähtien otetaan huomioon toissijaiset paristot tai paristot. Kuten elohopea, myös nikkeli-kadmiumparistot ovat haitallisia ympäristölle (kadmiummetallien eläimistölle ja terveydelle).
Niille on ominaista tuottaa korkeat sähkövirrat ja suuri määrä kertoja voidaan ladata. Itse asiassa 2000 kertaa voidaan ladata, mikä on yhtä suuri kuin poikkeuksellinen kestävyys.
Sen elektrodit koostuvat nikkelioksidihydroksidista, lapsesta (OH) katodille ja metallisesta kadmiumista anodille. Kemiallinen perusta on pohjimmiltaan edelleen sama: kadmium (sinkin sijasta) menettää elektroneja ja kadmium Nio (OH) voittaa ne.
Puolireaktiot ovat:
CD (S) + 2OH-(AC) → CD (OH)2(s) + 2e-
2NIO (OH) (S) + 2H2Tai (l) + 2e- → 2NI (OH)2(S) + OH-(AC)
Voi anionit-, Jälleen he tulevat KOH -elektrolyytistä. Nicad -akut lopulta tuottavat nikkeli- ja kadmiummetallihydroksidit.
Niitä käytetään erikseen tai kytkettynä pakkauksissa (kuten keltainen, ylivoimainen kuva). Ne tulevat sitten suuriin tai pieniin paketteihin. Pienet löytävät käyttöä leluissa; Mutta suuret, on tarkoitettu lentokoneisiin ja sähköajoneuvoihin.
- Nikkel-hydro-metallinen pilas (Ni-HM)
 Ni-HM-paristot. Lähde: Flickrin Ramsh Ng (https: // www.Flickr.com/valokuvat/rameshng/5645036051)
Ni-HM-paristot. Lähde: Flickrin Ramsh Ng (https: // www.Flickr.com/valokuvat/rameshng/5645036051) Toinen tunnettu akku tai akku, joka ylittää Nicadin energiakapasiteetissa, on Ni-HM (nikkeli ja metallinen hydridi). Se voi tulla lieriömäisessä muodossa (tavanomaiset akut, ylivoimainen kuva) tai kytketty akkuun.
Kemiallisesti esiintyy melkein samat ominaisuudet kuin NICAD -akut, ja tärkein ero perustuu sen negatiiviseen elektrodiin: katodi ei ole kadmium, vaan harvinaisten maametallien ja siirtymämetallien metallien välinen seos.
Voi palvella sinua: kiertokuivaus: toiminta, mihin se on, osat, sovelluksetTämä seos on vastuussa vedyn absorboimisesta, joka muodostuu kuorman aikana, tuottaen kompleksisen metallihydridin (siis nimessä H -kirjain H).
Vaikka Ni-HM-akut tarjoavat enemmän energiaa (noin 40% enemmän), ovat kalliimpia, ne käyttävät nopeammin, eikä niitä voida ladata samana määrään kertoja kuin NICAD-akut; eli heillä on pienempi käyttöikäaika. Heillä ei kuitenkaan ole muistivaikutus (akun suorituskyvyn menetys ei ole täysin vapautettu).
Juuri tästä syystä niitä ei tule käyttää koneissa, jotka toimivat pitkällä aikavälillä; Vaikka tämä ongelma on täynnä LSD-NIHM-paristoja. Samoin Ni-HM-paristoilla tai paristoilla on erittäin vakaat lämpöominaisuudet, jotka ovat käytettävissä monissa lämpötiloissa edustamatta riskiä.
Reaktiot
Heidän elektrodissa esiintyvät reaktiot ovat:
Ni (OH)2(S)+ OH-(ac) ⇌ nio (OH) (s) + H2Tai (l) + e-
H2Tai (l) + m (s) + e- ⇌ Voi-(AC)+ MH (s)
- Ion-litio-akut
 Kannettavan tietokoneen litium-ioni-akku. Lähde: Wikipedian Kristoferb.
Kannettavan tietokoneen litium-ioni-akku. Lähde: Wikipedian Kristoferb. Paristoissa ja litiumparistoissa ne perustuvat Li -ionien siirtymiseen+, jotka siirretään anodista katodiin, kasvavan positiivisen varauksen sähköstaattisten torjumien tuote.
Jotkut voivat ladata, kuten kannettavan tietokoneen paristot (ylivoimainen kuva) ja toiset, lieriömäinen ja suorakaiteen muotoinen (sileä2, Lisocl2 tai limusiin2) Ei.
Ion-litio-akkuille on ominaista erittäin kevyt ja energia, mikä mahdollistaa niiden käytön monissa elektronisissa laitteissa, kuten älypuhelimissa ja lääketieteellisissä laitteissa. He kärsivät myös tuskin muistivaikutuksesta, niiden kuormitustiheys ylittää NICAD- ja Ni-HM-akkujen ja paristojen ja viivästyttää enemmän lataamisessa.
Ne ovat kuitenkin erittäin herkkiä korkeille lämpötiloille, jopa räjähtää; Ja lisäksi ne ovat yleensä kalliimpia muiden akkujen edessä. Silti markkinoilla litiumparistot nähdään hyvillä silmillä, ja monet kuluttajat ovat parhaita.
- Hapan lyijyakut
 Tyypillinen karfiautoakku. Lähde: TntFlash [CC BY-Sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Tyypillinen karfiautoakku. Lähde: TntFlash [CC BY-Sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Ja lopuksi, hapan lyijybakteerit, kuten nimestä päätetään, eivät sisällä OH -ioneja- mutta h+; spesifisesti tiivistetty rikkihappo liuos. Voltaic -solut ovat laatikossaan (ylempi kuva), missä kolme tai kuusi niistä voidaan kytkeä sarjaan, mikä antaa vastaavasti akun 6 tai 12 V,.
Se pystyy tuottamaan suuria määriä sähkövarausta, ja koska ne ovat erittäin raskaita, ne on tarkoitettu sovelluksille tai laitteille, joita ei voida kuljettaa manuaalisesti; Esimerkiksi autot, aurinkopaneelit ja sukellusveneet. Tämä happoakku on vanhin ja on edelleen voimassa autoteollisuudessa.
Elektrodit on tehty lyijystä: PBO2 Katodille ja anodille sponginen metallinen lyijy. Niissä esiintyvät reaktiot ovat:
PB (S) +HSO-4(aq) → PBSO4(s) +h+(aq) + 2e-
Pbo2(S) +HSO-4(aq) + 3h+(aq) + 2e- → PBSO4(s) + 2h2Tai (l)
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Odunlade Emmanuel. (24. heinäkuuta 2018). Erityyppiset paristot ja laitteet. Piiri. Palautettu: CircuitDigest.com
- PRBA. (S.F.-A. Paristotyypit. Toipunut: PRBA.org
- Isidor Buchman. (2019). Mikä on paras akku? Akkuyliopisto. Haettu: BatteryLiversity.com
- McGraw-Hill -yritykset. (2007). Luku 12: Paristot. [PDF]. Toipunut: Oakton.Edu
- Shapley Patricia. (2012). Yhteiset akkutyypit. Illinoisin yliopisto. Toipunut: butaani.Kemia.Uic.Edu
- Ekologinen asenne. (22. tammikuuta 2017). Akkutyypit: Täydellinen opas, jossa on paristoja ja paristoja. Haettu: Ekcology.com
- « Tomás Mejían elämäkerta, sotilaallinen ura, ammunta
- Happahydridit miten muodostuu, sovellukset ja esimerkit »

