Neutraali atomi
- 3999
- 1106
- Louis Moen
Mikä on neutraali atomi?
Eräs neutraali atomi Se puuttuu sähkövaraus johtuen sen protonien ja elektronien lukumäärän välisestä korvauksesta. Molemmat ovat sähköisesti ladattuja subatomisia hiukkasia.
Protonit ovat agglomeroituneita neutronien vieressä ja muodostavat ytimen; kun taas elektronit hämärtyvät määrittelemällä elektroninen pilvi. Kun atomin protonien lukumäärä, yhtä suuri kuin sen atomiluku (z), on yhtä suuri kuin elektronien lukumäärä, sanotaan.
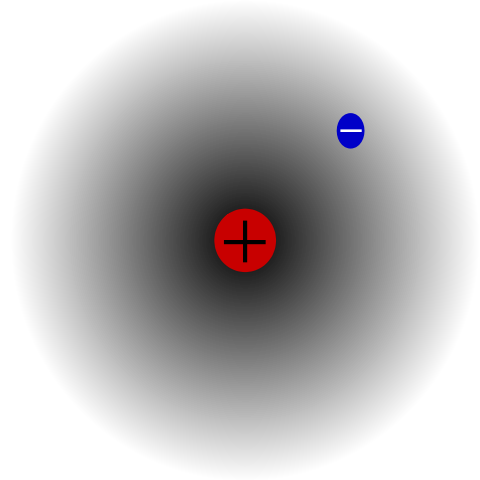
 Vetyatomi. Lähde: Mets501 Wikipedian kautta.
Vetyatomi. Lähde: Mets501 Wikipedian kautta. On esimerkiksi vetyatomi (ylivoimainen kuva), jolla on protoni ja elektroni. Protoni on sijoitettu atomin keskelle sen ytimeksi, kun taas elektroni kiertää ympäröivää tilaa, jättäen vähemmän elektronisen tiheyden alueita, kun se siirtyy pois ytimestä.
Tämä on neutraali atomi, koska on totta, että z on yhtä suuri kuin elektronien lukumäärä (1p = 1e). Jos H: n atomi menettäisi yhden protonin, atomisäde olkaisiin ja se vallitsisi protonin kuormituksen, tulen hintaan+ (Hydon). Jos toisaalta se voittaisi elektronin, olisi kaksi elektronia ja siitä tulee anioni H-- (Hydridi).
Neutraali vs. ioniatomi
H: n neutraalin atomin esimerkissä nähtiin, että on täytetty, että protonien lukumäärä on yhtä suuri kuin elektronien lukumäärä (1p = 1e); tilanne, jota ei tapahdu ionien kanssa Elektronin menetys tai voitto.
Ionit muodostuvat elektronien lukumäärän muutoksella joko siksi, että atomi voitto (-) tai menettävät ne (+).
Voi palvella sinua: hajautettu vaiheKationin h+ Yksinäisen protonin Valencia on vallitseva elektronin kokonaispuuttumisen edessä (1p> 0e). Tämä pätee kaikkiin muihin jaksollisen taulukon raskaampiin atomeihin (NP> ne).
Vaikka positiivisen taakan läsnäolo voi tuntua merkityksettömältä, hän muuttaa diagonaalisesti kyseisen elementin ominaisuuksia.
Toisaalta anioniatomi H- Kahden elektronin negatiivinen kuorma hallitsee ytimen ainoan protonin edessä (1p<2e). Igualmente, los demás aniones de mayor masa tienen un exceso de electrones en comparación al número de protones (np
Na vs na+
Tunnettu esimerkki on metallinen natrium. Sen neutraalilla atomilla, NA: lla, Z = 11, on 11 protonia; Siksi positiivisten kuormitusten kompensoimiseksi on oltava 11 elektronia (11p = 11e).
Natrium, joka on erittäin elektropositiivinen metallielementti, menettää elektronit erittäin helposti; Tässä tapauksessa se menettää vain yhden, sen Valencia -kerroksen (11p> 10e). Siten muodostuu Na -kationi+, joka on vuorovaikutuksessa sähköstaattisesti anionin kanssa; Kuten kloridi, cl-, Suolakloridisuolassa NaCl.
Metallinen natrium on myrkyllistä ja syövyttävää, kun taas sen kationia on jopa solujen sisällä. Tämä osoittaa, kuinka elementin ominaisuudet voivat vaihdella rajusti, kun se voittaa tai menettää elektroneja.
Toisaalta Nion Na- (souduro, hypoteettisesti) ei ole; Ja pystyä muodostamaan se olisi erittäin reaktiivista, koska se on natriumin kemiallisen luonteen vastainen voittamaan elektroneja. Sitten eräs- Sillä olisi 12 elektronia, voittamalla ytimen positiivisen varauksen (11p<12e).
Voi palvella sinua: molekyylihappi: rakenne, ominaisuudet, käytötNeutraalit molekyylit
Atomit yhdistetään kovalenttisesti molekyylien aiheuttamiseksi, jota yhdistettä voidaan kutsua myös. Molekyylissä ei voi olla eristettyjä ioneja; Sen sijaan on atomeja, joilla on positiivisia tai negatiivisia muodollisia kuormia. Nämä ladattu.
Jotta molekyyli olisi neutraali, sen atomien muodollisten kuormitusten summan on oltava yhtä suuri kuin nolla; Tai yksinkertaisemmin kaikki sen atomit ovat neutraaleja. Jos molekyylin muodostavat atomit ovat neutraaleja, tämä on myös.
Esimerkiksi, sinulla on vesimolekyyli, H2JOMPIKUMPI. Sen kaksi H -atomia ovat neutraaleja, aivan kuten happiatomi. Niitä ei voida esittää samalla tavalla kuin vetyatomin kuvassa; Koska ydin ei muutu, elektroninen pilvi tapahtuu.
Hydronio -ioni, H3JOMPIKUMPI+, Toisaalta siinä on happiatomi positiivisella osittaisella kuormalla. Tämä tarkoittaa, että siinä polyiatomisissa ionissa se menettää elektronin, ja siksi sen protonien lukumäärä on suurempi kuin sen elektronien lukumäärä.
Esimerkkejä neutraaleista atomeista
Happi
Neutraalilla happiatomilla on 8 protonia ja 8 elektronia. Kun hän voittaa kaksi elektronia, muodostaa niin kutsutun oksidianionin tai2-. Siinä negatiiviset kuormat ovat vallitsevia, ja niiden ylimääräinen kaksi elektronia (8p<10e).
Neutraalit happiatomilla on suuri taipumus reagoida ja liittyä itsensä kanssa muodostaakseen tai2. Tästä syystä siellä ei ole atomeja tai "löysää" siellä kohtaloasi ja reagoimatta mihinkään. Kaikki tämän kaasun tunnetut reaktiot myönnetään molekyylihapelle tai2.
Se voi palvella sinua: alkalinottimet metallitKupari
Kuparilla on 29 protonia ja 29 elektronia (neutronien lisäksi). Toisin kuin happea, niiden neutraalia atomeja löytyy luonnosta niiden metallisidoksen ja suhteellisen stabiilisuuden vuoksi.
Natriumin tavoin sillä on taipumus menettää elektroneja niiden voittamisen sijaan. Sen elektronisen kokoonpanon ja muiden näkökohtien vuoksi voit menettää yhden tai kaksi elektronia, ja siitä tulee cupros+, o Cuprico, Cu2+, vastaavasti.
Cucion cu+ Siinä on vähemmän elektronia (29p<28e), y el Cu2+ on menettänyt kaksi elektronia (29p<27e).
jalokaasut
Jalokaasut (hän, ne, ar, kr, xe, rn) ovat yksi harvoista elementeistä, jotka ovat olemassa niiden neutraalien atomien muodossa. Hänen atominumeronsa ovat: 2, 10, 18, 36, 54 ja 86, vastaavasti. He eivät voita tai menetä elektroneja; Vaikka Xenon, XE, voi muodostaa yhdisteitä fluorilla ja menettää elektroneja.
Metalliseokset
Metallit on suojattu korroosiolta, voi ylläpitää neutraaleja atomeja, jotka yhdistävät metallilinkit. Seoksissa, kiinteät metalliliuokset, atomit pysyvät (enimmäkseen) neutraaleina. Esimerkiksi messinkillä on neutraalit atomit Cu ja Zn.
Viitteet
- Mikä on neutraali atomi? Toipunut: Johdanto fysiikkaan.com
- Ei -neutraalit atomit esimerkki. Tiede. Toipunut: tiedekunnasta.com

