Lyijyjodidirakenne, ominaisuudet, hankkiminen, käyttö

- 2876
- 619
- Joshua Emmerich
Hän Lyijyjodidi Se on epäorgaaninen yhdiste, jonka lyijyelementti (PB) muodostaa hapettumisen +2 ja jodissa (I) Valencia -1: n kanssa. Sen kemiallinen kaava on BKT2. Se on myrkyllinen yhdiste. Koska se on johtaminen, on haitallista ihmiselle, eläimille ja luonnollisille ekosysteemeille. Lisäksi jodidi voi aiheuttaa myös joitain sairauksia.
BKT -yhdiste4, Tämä on, että hapettumisessa +4 lyijy näyttää siltä, että sitä ei ole olemassa, luultavasti jodidi -ionin vähentämiskyvyn vuoksi (I--A. BKT2 Se on kiinteä keltainen väri, joka on vähän liukeneva veteen.
 Lyijyjodidi (BKT2) kiinteä. W -. OELEN/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons.
Lyijyjodidi (BKT2) kiinteä. W -. OELEN/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons. Se voidaan saada käyttämällä ioninvaihtoreaktiota jodidisuolan ja johdon välillä, jotka molemmat liukoiset veteen.
Sillä on puolijohdeominaisuuksia, joten suurin osa sen nykyisistä sovelluksista on aurinkosähkölaitteissa, tiettyjen säteily- ja anturien ilmaisimissa.
Yksi tämän yhdisteen tutkituimmista käytöistä on Perovskita -aurinkokennot, jotka ovat osoittautuneet erittäin tehokkaiksi ja alhaisiksi kustannuksiksi.
[TOC]
Rakenne
Johtavassa jodidissa sen atomien välinen liitto on ioninen vain osittain. Atomit muodostavat kerroksia, joilla on kuusikulmainen rakenne ja ne on kytketty toisiinsa van der Waalsin heikkojen voimien kautta.
Nämä voimat eivät ole ionisia eikä kovalenttisia, ovat heikkoja vuorovaikutuksia atomien elektronisten kerrosten välillä.
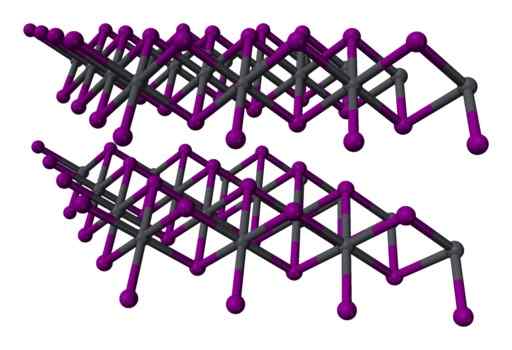 Kaksi -lauantai -leimaarirakenne2 kiteinen. Harmaa = lyijy; Violetti = jodi. Benjah-BMM27 / julkinen verkkotunnus. Lähde: Wikimedia Commons.
Kaksi -lauantai -leimaarirakenne2 kiteinen. Harmaa = lyijy; Violetti = jodi. Benjah-BMM27 / julkinen verkkotunnus. Lähde: Wikimedia Commons. Nimikkeistö
- Lyijyjodidi
- Lyijyjodidi (II)
- Diyoduro
- Plumboso -jodidi
Ominaisuudet
Fyysinen tila
Kirkkaankeltainen kiteinen kiinteä. Kuusikulmaiset kiteet.
 Kuusikulmaiset kiteet lyijyjodidista. Alessandro e damiano/cc by (https: // creativecommons.Org/lisenssit/by/4.0). Lähde: Wikimedia Commons.
Kuusikulmaiset kiteet lyijyjodidista. Alessandro e damiano/cc by (https: // creativecommons.Org/lisenssit/by/4.0). Lähde: Wikimedia Commons. Molekyylipaino
461 g/mol
Sulamispiste
410 ºC
Kiehumispiste
954 ° C, keitä hajoamisella.
Tiheys
6,16 g/cm3
Liukoisuus
Vesiliukoinen kevyesti: 0,076 g/100 ml 25 ° C: ssa. Kuumavesi liukoinen. Liukenematon alkoholiin ja kylmään suolahappoon (HCL).
Voi palvella sinua: Natrium: Historia, rakenne, ominaisuudet, riskit ja käyttötarkoituksetKemialliset ominaisuudet
Sen hapettavat ja pelkistävät ominaisuudet ovat heikkoja. Voit kuitenkin esitellä oksidenuktioreaktioita.
Vaikka se on hyvin vähän liukoinen veteen liukenee alkalisten jodidien, kuten kaliumjodidin (KI), tiivistettyihin liuoksiin. Se liukenee konsentroituun natriumasetaatin liuokseen (CH3Tasku). Se liukenee vapaasti natriumtiosulfaattiliuokseen (na2S2JOMPIKUMPI3-A.
Jotkut kirjoittajat osoittavat, että vedessä ioni PBI voidaan tuottaa+ Ja jos ioni -ioni on ylimääräinen (i-) monimutkaisemmat lajit, kuten BKT, voidaan muodostaa3- ja BKT42-, muun muassa.
Se ei ole syttyvä.
Muut fysikaaliset ominaisuudet
Se käyttäytyy puolijohteena, ts.
Se on suora rako -puolijohde, ts. Yhden sen elektronien siirtyminen Valencia -kaistalta ajoon, sillä on oltava vain määrä energiaa, joka on yhtä suuri kuin kielletty kaistanleveys.
Sen elementtien korkean atomien lukumäärän vuoksi (pb = 82, i = 53), sillä on korkea valosähköinen kapasiteetti. Sen 2,5 koskaan aukko kaista mahdollistaa korkean tehokkuuden aurinkosähkön suorituskyvyn lämpötiloissa 250 ° C: seen.
Saada
Se voidaan valmistaa reagoimalla vesiliukoinen yhdiste iaarhydiinihapolla (HI) tai liukoisella metallijodidilla. Esimerkiksi kaliumjodidilla varustetun lyijyasetaatin vesiliuos: sekoitetaan:
PB (CH3Kujertaa)2 + 2 Ki → BKT2↓ + 2 K (valitse3Kujertaa)
Tämän tyyppistä reaktiota kutsutaan "ioninvaihdona", koska kationit ja anionit vaihdetaan suolojen välillä.
Mainitussa esimerkissä kaliumasetaatti on hyvin liukoinen veteen ja pysyy liuenneet, kun taas kaliumjodidi on vähemmän liukoinen, saostuma ja suodatin. Puhdistus tehdään uudelleen kiteyttämällä yhdiste vedessä.
Voi palvella sinua: kiteytyminenPBI -sade2 Seuraavassa kuvassa voidaan nähdä, joka näyttää koeputken, jossa lyijynitraatti (II) (PB (ei3-A2) ja kaliumjodidi (KI) vesiliuoksessa. Tätä vaikutusta kutsutaan "kultaa".
 BKT: n kullan sade2. Stefano SCT/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons.
BKT: n kullan sade2. Stefano SCT/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons. Sovellukset
Puolijohteena
Sitä käytetään ilmaisimena korkean energian fotoneille, kuten x -säteille ja gammasäteille. Sitä voidaan käyttää aurinkosähkölaitteissa, valokennoissa, LED -valoissa, optisissa ilmaisimissa sekä biologisissa luokituksissa ja anturissa.
Jos nanorakenteisiin tuotu, sitä voidaan käyttää fotokatalyysissä ja aurinkokennoissa. Lisäksi monet BKT: n nanohiukkaset2 Niillä on luminesoivia ominaisuuksia.
 Lyijyjodidia käytetään x -gray -lääketieteellisissä ilmaisimissa. Kirjoittaja: LKCJJang40090. Lähde: Pixabay.
Lyijyjodidia käytetään x -gray -lääketieteellisissä ilmaisimissa. Kirjoittaja: LKCJJang40090. Lähde: Pixabay. Aurinkokennot
BKT2 Se on välittäjä aurinkokennoille tarkoitettujen perovskitasin synteesissä. Tämäntyyppiset aurinkosähkökennot sisältävät metyyliammoniumin ja lyijyjodidin (valitse3Nh3BKT3) Setän perusteella2.
Tällaisilla laitteilla on korkea hyötysuhde ja alhaiset kustannukset, joten ne ovat olleet paljon tutkimusta ja tutkimusta.
 Aurinkokennot talon katolla kentällä. Aurinkokennoja, joissa käytetään PBI: tä2 Ne ovat erittäin tehokkaita eivätkä ole kovin kalliita, joten niitä voidaan käyttää taloissa tulevaisuudessa. Kirjoittaja: Manfred Antranias Zimmer. Lähde: Pixabay.
Aurinkokennot talon katolla kentällä. Aurinkokennoja, joissa käytetään PBI: tä2 Ne ovat erittäin tehokkaita eivätkä ole kovin kalliita, joten niitä voidaan käyttää taloissa tulevaisuudessa. Kirjoittaja: Manfred Antranias Zimmer. Lähde: Pixabay. Kuitenkin CHO: n jälkeen3Nh3BKT3 Se voi hajottaa sadeveden kanssa, on tutkittu, kuinka saastuttavat nämä solut voivat olla molemmat käytössä ja kun ne hylätään.
CH3Nh3BKT3 Kosketuksessa veden kanssa se murtuu metyyliamiiniksi (valitse3Nh2), Yodhydric -happo ja BKT2. Jälkimmäinen, vaikka se on vähän liukoinen veteen, ajan myötä voi vapauttaa määrät myrkyllisestä ionista PB2+.
Tutkimukset eivät ole vakuuttavia, koska paikka, jossa lyijyn vapauttaminen tapahtuu, määrittää, voiko määrä olla haitallinen lyhyellä aikavälillä. Toisaalta jatkuva vapautus voi biokermoitua ja olla erittäin vaarallinen.
Voi palvella sinua: butanone: rakenne, ominaisuudet ja käytötMuut sovellukset
- Se kylvetään pilvien suihke muodossa sateen tuottamiseksi.
- Etäisen infrapuna -astronomian suodattimissa.
- Valokuvassa, vaikutelmat, elokuvat optisten kuvien, valokuvaemulsioiden tallentamiseksi.
- Jarrupäällyste. Voitelussa rasvoissa.
- Elohopeahöyrykaarivalaisimet. Sähköpaperilla.
- Termoelektriset materiaalit, lämpöakut jodilla.
Riskejä
Turvallisuus
Se on säilytettävä kaukana hapettimista, kuten peroksidit, peroksidit, permanganaatit, kloorit ja nitraatit. Kosketus kemiallisesti aktiivisten metallien, kuten kaliumin, natriumin, magnesiumin ja sinkin kanssa. Kaikissa näissä tapauksissa voi tapahtua väkivaltainen reaktio.
Jos lämmitetään, syntyy myrkyllisiä lyijyn ja jodin kaasuja.
Terveydelle
On erittäin haitallista ihmiselle. On vahvistettu, että se on karsinogeeni eläimille, siksi on kohtuudella päätellä, että se on myös ihmiselle.
Se voi aiheuttaa päänsärkyä, ärtyneisyyttä, vähentää muistia ja häiritä unta. Tämän yhdisteeseen sisältyvä lyijy voi aiheuttaa pysyviä vaurioita munuaisten, aivojen, hermoille, verisoluille ja korkeapaineriskille.
Sitä on käsiteltävä teratogeeninä (yhdiste, joka voi tuottaa synnynnäisen vian). Se voi myös tuottaa jodismia, jonka oireet ovat sieraimien ruuhka, päänsärky, limakalvojen ärsytys ja ihonpurkaus.
Luonnonympäristölle
Se luokitellaan myrkylliseksi epäpuhtaukseksi. Se on pidettävä poissa vedestä ja tyhjennyslähteistä. Painojen saastuttamisen välttämiseksi tulisi rakentaa aina, kun se on tarpeen säilyttää.
Se on erittäin myrkyllistä vesielämälle, jolla on vaikutuksia, jotka kestävät ajan myötä, koska se on biologinen.
Viitteet
- Lyijy, d.R -. (Toimittaja) (2003). CRC: n kemian ja fysiikan käsikirja. 85th CRC -lehdistö.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Lyijyjodidi. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- EVSTROPIEV; S.K -k -. et al. (2020). PVP/PBI: n synteesi ja karakterisointi2. Adv Compos Hybrid Mater 3, 49-57 (2020). Linkki palautettu.Jousto.com.
- Ismail, r.-Lla. et al. (2016). PBI: n synteesi2 Nanohiukkaset laser -ablaatiolla metanolissa. J Mater Sci: Mater Electron 27, 10696-10700 (2016). Linkki palautettu.Jousto.com.
- Materiaalit. (2013). Lyijyjodidi (BKT2) Puolijohde. Azomista toipunut.com.
- CDH (2008). Lyijy (ii) jodidi. Turvallisuustietolomateriaali. CHDFINECHECHICAL.com.
- HAILEGNAW, B. et al. (2015). Sade metyyliammoniumin lyijyjodidipohjaisilla perovskiteilla: Perovskite -aurinkokennojen mahdolliset ympäristövaikutukset. J -. Fyysinen. Kemia. Letti. 2015, 6, 9, 1543-1547. Pubista toipunut.ACS.org.
- Wikimedia -säätiö (2020). Lyijy (ii) jodidi. Haettu jstk.Wikipedia.org.
- « Lyijyasetaatirakenne, ominaisuudet, hankkiminen, käyttö
- Objektiivisen yrityksen organisointi, rakenne, esimerkki »

