Napaisuus (kemia) Mikä on, määritelmä, esimerkit
- 1574
- 240
- Gabriel Fahey
Mikä on kemiallinen napaisuus?
Se Kemiallinen napaisuus Se on ominaisuus, jolle on ominaista elektronisten tiheyksien huomattava heterogeeninen jakauma molekyylissä. Siksi sen rakenteessa on negatiivisesti ladattuja alueita (Δ-) ja muut positiivisesti varautuneet (Δ+), mikä tuottaa dipolimomentin.
Linkin dipolimomentti (µ) on molekyylin napaisuuden ekspression muoto. Se on yleensä esitetty vektorina, jonka alkuperä on kuormassa (+) ja sen pää sijaitsee kuormassa (-), vaikka jotkut kemikaalit edustavat sitä päinvastaisesti.
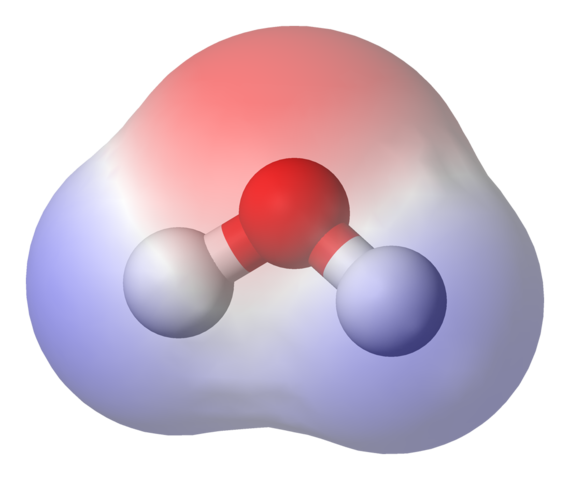
 Vesimolekyylin sähköstaattinen potentiaalikartta. Lähde: Benjah-BMM27 Wikipedian kautta.
Vesimolekyylin sähköstaattinen potentiaalikartta. Lähde: Benjah-BMM27 Wikipedian kautta. Yläkuvassa esitetään sähköstaattinen potentiaalikartta vedelle, h2JOMPIKUMPI. Punertavan alueen (happiatomi) vastaa sitä, jolla on suurin elektroninen tiheys, ja voidaan myös nähdä, että se erottuu sinisistä alueista (vetyatomeista).
Koska mainitun elektronisen tiheyden jakautuminen on heterogeenistä, sanotaan, että on olemassa positiivinen ja negatiivinen napa. Siksi puhumme kemiallisesta napaisuudesta ja toistaiseksi dipolista.
Dipolaarinen hetki
Dipolimomentti µ määritellään seuraavalla yhtälöllä:
µ = Δ ·d -d
Missä δ on kunkin navan sähkövaraus, positiivinen (+Δ) tai negatiivinen (-δ) ja d -d Se on etäisyys niiden välillä.
Dipolimomentti ilmaistaan yleensä Debyessä, jota edustaa symboli D. Coulomb · Metro vastaa 2 998 · 1029 D -d.
Kahden eri atomin välisen yhteyden dipolimomentin arvo on suhteessa linkin muodostavien atomien elektronegatiivisuuden eroon.
Jotta molekyyli olisi polaarinen, ei riitä, että sen rakenteessa on polaarisia linkkejä, mutta sen on myös oltava epäsymmetrinen geometria; Tällä tavalla se estää dipolimomentteja kumoamasta toisiaan.
Voi palvella sinua: Hiilidit: elementit, ominaisuudet ja käytötVesimolekyylin epäsymmetria
Vesimolekyylissä on kaksi O-H-sidosta. Molekyylin geometria on kulma, toisin sanoen "V" -muodossa; Joten linkkien dipolimomentit eivät peruuta toisiaan, vaan niiden summa tapahtuu osoittamalla kohti happiatomia.
Sähköstaattinen potentiaalikartta H: lle2Tai heijasta tätä.
Jos havaitaan H-O-H-kulmamolekyyli, voi esiintyä seuraava kysymys: onko se todella epäsymmetrinen? Jos piirretään kuvitteellinen akseli, joka ylittää happiatomin, molekyyli jaetaan kahteen yhtä suureen puoliskoon: H-O | O-H.
Mutta se ei ole niin, jos kuvitteellinen akseli on vaakasuora. Kun tämä akseli jakaa nyt molekyylin jälleen kahteen puolikkaaseen, happiatomilla on toisaalta ja toisaalta kaksi vetyatomia.
Siksi H: n ilmeinen symmetria2Tai lakkaa olemasta, ja siksi otetaan huomioon epäsymmetrinen molekyyli.
Polaariset molekyylit
Polaarimolekyylien on täytettävä sarja ominaispiirteitä, kuten:
-Sähkövarausten jakautuminen molekyylirakenteessa on epäsymmetrinen.
-Ne ovat yleensä liukenevia veteen. Tämä johtuu polaaristen molekyylien välillä, jotka voivat olla vuorovaikutuksessa dipoli-dipolovoimien avulla, missä vedelle on ominaista suuri dipolimomentti.
Lisäksi sen dielektrinen vakio on erittäin korkea (78,5), jonka avulla voit ylläpitää erillisiä sähkökuormia lisäämällä sen liukoisuutta.
-Polaarimolekyyleillä on yleensä korkea kiehumis- ja fuusiopisteet.
Nämä voimat muodostavat Dipolo-Dipolo-vuorovaikutuksen, Lontoon dispergoivat voimat ja vety sillojen muodostumisen.
Voi palvella sinua: Rautasulfaatti (FESO4): Mikä on, rakenne, ominaisuudet, synteesi-Sähkövarauksensa vuoksi polaariset molekyylit voivat ajaa sähköä.
Esimerkit
Sw2
Rikkidioksidi (niin2-A. Hapen elektronegatiivisuus on 3,44, kun taas rikkielektronegatiivisuus on 2,58. Siksi happi on enemmän elektronegatiivista kuin rikki. On olemassa kaksi linkkiä s = o, joissa on tai yksi kuorma Δ- ja s a-kuorma δ+.
Koska se on kulma molekyyli, jossa S -kärjessä on, kaksi dipolimomenttiä on suunnattu samaan suuntaan; Ja siksi ne lisäävät, tekevät niin molekyylistä2 olla polaarinen.
CHCL3
Kloroformi (HCCL3-A. Siellä on C-H-linkki ja kolme C-CL-linkkiä.
C: n elektronegatiivisuus on 2,55 ja H: n elektronegatiivisuus on 2,2. Siten hiili on enemmän elektronegatiivista kuin vety; Ja siksi dipolimomentti suuntautuu H (Δ+) C (Δ-): cΔ--HΔ+.
C-CL-linkkien tapauksessa C: n elektronegatiivisuus on 2,55, kun taas CL: n elektronegatiivisuus on 3,16. Dipoli- tai dipolimomentti on suunnattu C: stä CL: ään kolmessa C -linkissä Δ+-Cl Δ-.
Kun elektronien alue on huono, vetyatomin ympärillä ja alue, jossa on runsaasti elektroneja, jotka koostuvat kolmesta klooriatomista, CHCL3 Sitä pidetään polaarisena molekyylinä.
HF
Vetyfluoridilla on vain yksi H-F-sidos. H: n elektronegatiivisuus on 2,22 ja F: n elektronegatiivisuus on 3,98. Siksi fluori päättyy suurimpaan elektroniseen tiheyteen, ja yhteys molempien atomien välillä kuvataan parhaiten seuraavasti: HΔ+-FΔ-.
Voi palvella sinua: Alumiinihydroksidi: rakenne, ominaisuudet, käytöt, riskitNh3
Ammoniakki (NH3) on kolme N-H-linkkiä. N: n elektronegatiivisuus on 3,06 ja H: n elektronegatiivisuus on 2,22. Kolmessa sidoksessa elektroninen tiheys on suunnattu typpelle, ja se on vielä suurempi vapaiden elektronien läsnäololla.
NH -molekyyli3 Se on tetraedrinen, kun N: n atomi miehittää kärkipisteen. Kolme dipolimehtoa, jotka vastaavat N-H-linkkejä, ovat suunnattu samaan suuntaan. Niissä Δ- sijaitsee N: ssä ja Δ+ H: ssa. Siten linkit ovat: nΔ--HΔ+.
Nämä dipolimomentit, molekyylin epäsymmetria ja typessä oleva elektronitto.
Makromolekyylit heteroátomosilla
Kun molekyylit ovat erittäin suuria, ei ole enää tarkkaa luokitella ne apolaariksi tai polaariksi itsessään. Tämä johtuu siitä, että sen rakenteesta voi olla osia sekä apolaarisilla (hydrofobisilla), kuten polaarisilla (hydrofiilisilla) ominaisuuksilla.
Tämäntyyppiset yhdisteet tunnetaan amfifiiloina tai amfipaattina. Koska apolaarista osaa voidaan pitää elektroneissa polaarisen osan suhteen, rakenteessa on polaarisuus ja amfipryyyliyhdisteitä pidetään polaarisina yhdisteinä.
Yleensä voidaan odottaa, että heteroatoomilla varustetulla makromolekyylillä on dipolimomentteja, ja sen kanssa kemiallinen napaisuus.
Ne, jotka ovat erilaisia kuin ne, jotka muodostavat rakenteen luuranat, ymmärtävät heteroátomos. Esimerkiksi hiilihapotettu luuranko on biologisesti tärkein kaikista, ja atomi, jonka kanssa hiili (vedyn lisäksi), sitä kutsutaan heteroátomoksi.
Viitteet
- Napa- ja ei -polaariset yhdisteet. Stri. Louis Community College. Palautettu: Käyttäjät.STLCC.Edu
- Kuinka selittää napaisuus. Tiede. Toipunut: tiedekunnasta.com

