Troponiinin ominaisuudet, rakenne, toiminnot ja testit
- 2226
- 269
- Shawn Stanton II
Troponiini Selkärankaisten luuranko- ja sydämen lihaksissa esiintyvä proteiini, joka liittyy lihaskuitujen filamenteihin ja jolla on toiminnot supistuvan aktiivisuuden säätelyssä (supistuminen ja lihasrelaksaatio), liittyy proteiiniin (supistuminen ja lihasrelaksaatio).
Lihaskuidut ovat soluja, jotka muodostavat lihaskudoksen, jonka supistumiskapasiteetti perustuu tilattujen filamenttien vuorovaikutukseen ja läheisesti niihin liittyvän suurimman osan sytoplasmisen tilavuudesta.
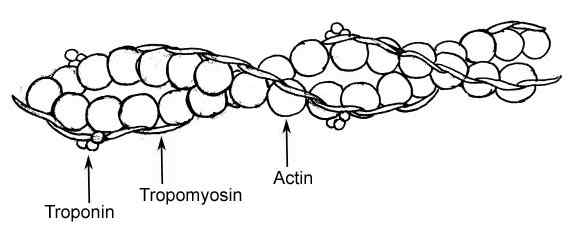 Lihaskuitujen ohuen filamentin elementtien graafinen esitys (lähde: RAUL654, Wikimedia Commonsin kautta)
Lihaskuitujen ohuen filamentin elementtien graafinen esitys (lähde: RAUL654, Wikimedia Commonsin kautta) Nämä filamentit tunnetaan myofilamenteina ja luokkia on kaksi: paksuus ja ohut. Paksut filamentit koostuvat myosiini II -molekyyleistä, kun taas ohuet filamentit ovat globaalia aktiinia tai aktiini -polymeerejä yhdessä kahden muun proteiinin kanssa.
Sekä aktiinia että myosiinia löytyy myös ihmisen kehon ja muiden organismien muista soluista, vain paljon vähemmän ja osallistuvat erilaisiin prosesseihin, kuten solujen kulkeutumiseen, eksosytoosiin, sytosiiniin (solun jakautumisen aikana) että jopa solunsisäisessä vesikulaarisessa liikenteessä.
Troponiini ja tropomiosiini ovat kaksi proteiinia, jotka liittyvät ohuisiin aktiinifilamenteihin, jotka osallistuvat lihassolujen tai kuitujen myofibrillien supistumis- ja rentoutumisprosessien säätelyyn.
Vaikutusmekanismit, joiden kautta nämä kaksi proteiinia käyttävät niiden toimintaa, liittyvät solunsisäiseen kalsiumpitoisuuteen. Troponiinin säätelyjärjestelmä on yksi tunnetuimmista järjestelmistä luuston lihaksen supistumisen fysiologiassa ja biokemiassa.
Nämä proteiinit ovat erittäin tärkeitä keholle. Tällä hetkellä tiedetään varmasti, että jotkut perhe- tai synnynnäiset kardiomyopatiat ovat mutaatioiden tuote joko koodavien geenien sekvenssissä (troponiini tai tropomiosiini).
[TOC]
Ominaisuudet
Troponiini liittyy luuranko- ja sydämen lihaksen lihaskuitujen ohuiden filamenttien aktiiniin stökiometrisessä suhteessa 1-7, toisin sanoen troponiinimolekyyli jokaisesta seitsemästä aktiinimolekyylistä.
Tätä proteiinia, sellaisena kuin se on stressaantunut, löytyy yksinomaan luuston ja sydämen raidottujen lihaskuitujen myofibrillien sisällä olevissa filamenteissa, eivätkä sileissä lihaskuiduissa, jotka muodostavat verisuoni- ja viskeraaliset lihakset.
Jotkut kirjoittajat suunnittelivat sen, kuten tropomiosiinin säätelyproteiini. Tällä tavalla sillä on unionin sivustoja vuorovaikutukseen aktiinimolekyylien kanssa, mikä antaa sille kyvyn säätää sen vuorovaikutusta paksujen filamenttien myosiinin kanssa.
Voi palvella sinua: Aldoheksosa: Molekyylirakenne ja esimerkitMyofilamenteissa troponiinin ja tropomiosiinimolekyylien välinen suhde on 1 - 1, mikä tarkoittaa, että jokaiselle olemassa olevalle troponiinikompleksille on tropomiosiinimolekyyli, joka liittyy tähän.
Rakenne
Troponiini on proteiinikompleksi, joka koostuu kolmesta erilaisesta globaalista alayksiköstä, jotka tunnetaan nimellä troponiini I, troponiini C ja troponiini T, jotka yhdessä lisäävät enemmän tai vähemmän, 78 kDa.
Ihmiskehossa on kudosspesifisiä variantteja jokaiselle näistä alayksiköistä, jotka eroavat toisistaan geneettisellä ja molekyylitasolla (suhteessa niitä koodaviin geeneihin), kuten rakenteellisella tasolla (niiden aminohappojen suhteen suhteen sekvenssit).
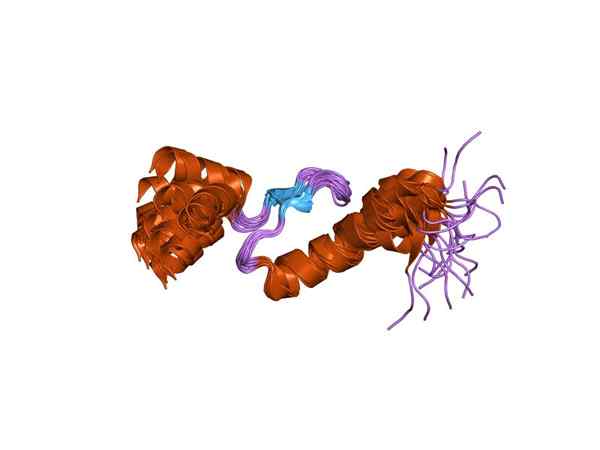
 Yhden troponiinin alayksikön edustaminen (lähde: Jawahar Swaminathan ja MSD: n henkilökunta Euroopan bioinformatiikan instituutissa [julkinen alue] Wikimedia Commonsin kautta)
Yhden troponiinin alayksikön edustaminen (lähde: Jawahar Swaminathan ja MSD: n henkilökunta Euroopan bioinformatiikan instituutissa [julkinen alue] Wikimedia Commonsin kautta) Toponiini C tai TNC on pienin kolmesta alayksiköstä ja ehkä yksi tärkeimmistä. Siinä on 18 kDa molekyylipaino ja siinä on paikkoja liittyä kalsiumiin (CA2+).
T- tai TNT -troponiini on se, jolla on unionin kohdat ankkuroimaan kolmen alayksikön kompleksin tropomiosiiniin ja sillä on 30 kDa molekyylipaino; Se tunnetaan myös nimellä t -abUnit- tai tropomiosiini -risteys.
Troponiinilla I tai TNI: llä, joka on hieman yli 180 aminohappojätteestä, on sama molekyylipaino kuin troponiinilla, mutta rakenteessaan siinä on erityiset kohdat liittyäkseen aktiiniin, estäen viimeksi mainitun ja myosiinin välisen vuorovaikutuksen, mikä on vastaava ilmiö lihaskuitujen supistumiseen.
Monet oppikirja. Sen kykyä yhdistää aktiinia ja sen estävää aktiivisuutta parantaa sen assosiaatio tropomioriiniin, välittää TNT -alayksikkö.
On osoitettu, että alayksikössä I estävän sekvenssin alue määritetään 12 aminohappojätteen keskuspeptidillä asentojen 104 ja 115 välillä; ja että alayksikön C-terminaalisella alueella on myös funktio estämisen aikana.
Funktiot
Troponiinin päätehtävä lihasten supistumisessa riippuu sen kyvystä liittyä kalsiumiin, koska tämä proteiini on ainoat ohuet filamentit rajattuun lihakseen, joka tällä ominaisuudella on.
Troponiinin puuttuessa ohuet filamentit kykenevät yhdistämään paksuja filamentteja ja supistumaan solunsisäisestä kalsiumpitoisuudesta riippumatta, joten troponiinin tehtävänä on välttää supistumista kalsiumin puuttuessa sen assosiaatioon tropomioriiniin.
Voi palvella sinua: OvuliparosSiten troponiinilla on tärkeä rooli lihasten rentoutumisen ylläpitämisessä, kun solunsisäistä kalsiumia ei ole tarpeeksi, ja lihasten supistumisessa, kun hermoston sähköstimulaatio mahdollistaa kalsiumin pääsyn lihaskuituun.
Kuinka tämä tapahtuu?
Luuranko- ja sydämen nauhoitetuissa lihaksissa lihasten supistuminen tapahtuu ohuiden ja paksujen filamenttien vuorovaikutuksen ansiosta, jotka liukuvat toistensa yli.
Näiden lihaksien soluissa kalsium on välttämätöntä toimivalle mulosiinin vuorovaikutukselle (ohuet ja paksut filamentit), koska aktiinin myosiinin unionin kohdat ovat "piilossa" tropomosiinin ja troponiinin yhteisen toiminnan avulla, mikä vastaa, mikä vastaa kalsiumiksi.
Kalsiumioonit, jotka tulevat sarkoplasmisesta retikulumista (lihaskuitujen endoplasminen retikulumi) sitoutuvat troponiinin alayksikköön C, joka neutraloi troponiinin välittämän eston ja lihasten supistumisen laukaisee.
Alayksikön I "neutralointi" tapahtuu kalsiumin liiton jälkeen alayksikköön C, joka tuottaa konformaatiomuutoksen, joka leviää kolmen alayksikön välillä ja mahdollistaa sen dissosioitumisen sekä aktiinimolekyylien että tropomioriinin välillä.
Tämä dissosiaatio troponiinin, tropomosiinin ja aktiinin välillä paljastaa aktiinissa myosiinin unionin sivustot. Silloin jälkimmäisen maailmanlaajuiset päät voivat olla vuorovaikutuksessa aktiinikuitujen kanssa ja aloittaa ATP-riippuvainen supistuminen johtuen yhden filamentin siirtymisestä toiseen.
Troponiinitesti
Troponiini on edullinen biomarkkeri sydämen vaurioiden havaitsemiseksi. Siksi troponiinitestiä käytetään laajasti joidenkin sydämen patologisten tilojen, kuten akuutin sydäninfarktin, biokemiallisessa, varhaisessa ja/tai ennaltaehkäisevässä diagnoosissa.
Monet hoitavat lääkärit katsovat, että tämä testi helpottaa päätöksentekoa -mitä tehdä ja mitä hoitoa rintakipulla olevien potilaiden antamiseksi.
Yleensä se liittyy troponiinin T- ja I -alayksiköiden havaitsemiseen, koska troponiini C Isforma löytyy myös hitaan supistumisen luuston lihaksista; eli se ei ole erityinen sydämelle.
Mikä on troponiinitestipohjainen?
Troponiinikoe on yleensä immuunitutkimus, joka havaitsee troponiinin sydämen isomuodot T- ja I -alayksiköt. Sitten se perustuu eroihin, jotka ovat molempien isoformien välillä.
Voi palvella sinua: proteiinisynteesiToponiini I (CTNI) alayksikön (CTNI) isoformi (CTNI)
Sydänlihaksen lihaskudoksessa troponiinin alayksikön I isoformi on vain yksi isomuoto, jolle on ominaista 32 aminohapon translaation jälkeisen "hännän" läsnäolo N-terminaalisessa päässä.
Tämä isomuoto havaitaan spesifisten monoklonaalisten vasta-aineiden kehittymisen ansiosta, jotka eivät tunnista muita ei-sydämen ei-isoformeja, koska aminohappo häntä on enemmän tai vähemmän 50% erilainen kuin muiden isoformien päät.
CTNI: tä ei ilmaista vaurioituneissa kankaissa, mutta se on yksinomainen aikuisen sydämen kudokselle.
Troponiinin t (ctnt) alayksikön (ctnt) isoformi (ctnt)
Troponiinin alayksikön Sydämisformi koodataan kolmeen eri geeniin, joiden ARNM voi kärsiä vaihtoehtoisista leikkauksista ja liitoksista, jotka johtavat isoformien tuottamiseen muuttuvilla sekvensseillä N-C-terminaalissa.
Vaikka ihmisten sydämen lihakset sisältävät 4 TNT -isoformia, vain yksi on ominaista aikuisen sydämen kudokselle. Tämä havaitaan spesifisillä vasta-aineilla, jotka on suunniteltu sen aminoocidal-sekvenssin N-terminaaliseen päähän.
Sydämen isoformin "uuden sukupolven" testit kiinnittävät paljon huomiota siihen, että jotkut loukkaantuneet luurankokudokset voivat paljastaa uudelleen tämän isomuodon, joten ristireaktiot voidaan saada vasta-aineilla.
Viitteet
- Babuin, l., & Jaffe, a. S. (2005). Troponiini: Valittu biomarkkeri sydänvaurion havaitsemiseksi. CMAJ, 173(10), 1191-1202.
- Collinson, P., Stubbs, P., & Kessler, a.-C. (2003). Monikeskuksen arviointi sydämen troponiini T: n, CK-MB-massan ja myoglobiinin diagnostisen arvon arvioinnista potilaita, joilla on epäillään akuutteja sepelvaltimo-oireyhtymiä rutiininomaisessa kliinisessä käytännössä. Sydän, 89, 280-286.
- Farah, c., & Reinach, f. (tuhatyhdeksänsataayhdeksänkymmentäviisi). Troponiinikompleksi ja lihaksen supistumisen säätely. Faseb, 9, 755-767.
- Keller, t., Peetz, D., Tzikas, s., Roth, a., Czyz, e., Bickel, c.,... Blankenberg, S. (2009). Herkkä troponiini I -määritys akuutin sydänlihaksen varhaisessa diagnoosissa. New England Journal of Medicine, 361(9), 868-877.
- Ross, m., & Pawlina, W. (2006). Histologia. Teksti ja atlas korreloivan solun ja molekyylibiologian kanssa (5. ed.-A. Lippinott Williams & Wilkins.
- Wakabayashi, t. (2015). Lihasten supistumisen kalsiumin säätelyn mekanismi. Rakenteellisen perustana. Proc. JPN. Akutti. Olla. B -, 91, 321-350.
- « Tropomiosiinin ominaisuudet, rakenne ja toiminnot
- Herkkä lämpökonsepti, kaavat ja harjoitukset ratkaistu »

